题目内容
12.下列各组物质分类正确的是( )| A | B | C | D | |
| 强电解质 | HF | HClO4 | Ba(OH)2 | 食盐水溶液 |
| 弱电解质 | Cu(OH)2 | NH3•H2O | BaSO4 | HClO |
| 非电解质 | Cu | SO2 | 蔗糖 | H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物,非金属氧化物、大多数的有机物(如蔗糖、乙醇等);
单质,混合物既不是电解质也不是非电解质.
解答 解:A、HF是弱电解质,铜是金属单质不是电解质,故A错误;
B、HClO4 是强酸属于强电解质,NH3•H2O是弱碱属于弱电解质,SO2 是非金属氧化物本身不能电离出离子属于非电解质,故B正确;
C、Ba(OH)2 是强碱属于强电解质,BaSO4 是盐属于强电解质,蔗糖是非电解质,故C错误;
D、食盐水是氯化钠的水溶液属于混合物,既不是电解质液不是非电解质,HClO是弱酸属于弱电解质,H2O是弱电解质,故D错误;
故选B.
点评 本题考查了强弱电解质的判断,明确电解质的相关概念、掌握影响弱电解质电离平衡,非电解质实质理解是解本题关键,题目难度中等.

练习册系列答案
相关题目
2.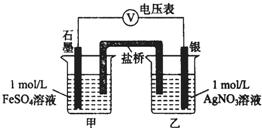 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:
注:经检验黑色固体为Ag.
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4 Ksp(或溶解度)更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.(或AgCl比Ag2SO4 Ksp(或溶解度)更小,促使平衡正向移动,银镜溶解).
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的Ksp(20度) AgCl:1.8×10-10 Ag2SO4:1.4×10-5
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL1mol/L AgNO3溶液加入到 1mL1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.
②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL2mol/LFe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/LFe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL2mol/LFeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与V的现象有所不同的原因溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4 Ksp(或溶解度)更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.(或AgCl比Ag2SO4 Ksp(或溶解度)更小,促使平衡正向移动,银镜溶解).
3.据报道,氢燃料电池公交汽车已经驶上北京街头.下列说法正确的( )
| A. | 氢燃料电池汽车的使用可以有效减少城市空气污染 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 发展氢燃料电池汽车不需要安全高效的储氢技术 | |
| D. | 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
20.下列图示关系中,错误的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
17.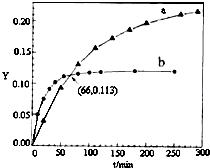 已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法不正确的是( )
已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法不正确的是( )
 已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法不正确的是( )
已知反应:2CH3COCH3(l)?CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示.下列说法不正确的是( )| A. | b代表20℃下CH3COCH3的Y-t曲线 | |
| B. | 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的$\frac{△n(0℃)}{△n(20℃)}$=1 | |
| C. | 升高温度可缩短反应达平衡的时间并能提高平衡转化率 | |
| D. | 反应进行到20min末,CH3COCH3的$\frac{v(0℃)}{v(20℃)}$<1 |
4.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 液态HCl不能导电,属于共价化合物 |
1.下列各组微粒中,各能层电子数均达到2n2个的是( )
| A. | Ne和 Ar | B. | H-和Na+ | C. | Ne和Cl- | D. | F-和S2- |
2.下列过程中需要吸收热量的是( )
| A. | 大理石的分解反应 | B. | 氢气燃烧 | ||
| C. | 氧化钙投入水中 | D. | 盐酸与氢氧化钠反应 |