题目内容
14.向某溶液中加入稀HNO3酸化的BaCl2溶液,有白色沉淀产生.该溶液含有( )| A. | CO32- | B. | OH- | C. | SO42- | D. | HCO3- |
分析 向某溶液中加入BaCl2溶液,再加入稀HNO3至溶液呈酸性,有白色沉淀产生,生成的白色沉淀是不溶于稀硝酸的硫酸钡沉淀或氯化银沉淀,原溶液中可能含有的阴离子为硫酸根离子或者亚硫酸根离子,以此解答该题.
解答 解:A.若是碳酸根离子,生成的碳酸钡溶于硝酸,不能判断是否含有碳酸根离子,故A错误;
B.氢氧根离子不能与氯化钡生成沉淀,无法判断是否含有氢氧根离子,故B错误;
C.溶液中含有硫酸根离子,加入氯化钡生成了不溶于稀硝酸的硫酸钡沉淀,故C正确;
D.碳酸氢根离子不能与氯化钡生成沉淀,无法判断是否含有碳酸氢根离子,故D错误;
故选C.
点评 本题考查了硫酸根离子的检验,为高频考点,侧重于学生的分析能力,记住常见的离子检验方法,本题注重了基础知识的考查,本题难度不大.

练习册系列答案
相关题目
10.下列过程中未发生氧化还原反应的是( )
| A. | 实验室用NH4Cl与NaNO2溶液混合微热制N2 | |
| B. | SnCl4与水的反应:SnCl4+2H2O═SnO2+4HCl | |
| C. | 人工树叶制取甲烷:CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2 | |
| D. | 银针验毒:4Ag+2H2S+O2═2Ag2S+2H2O |
5.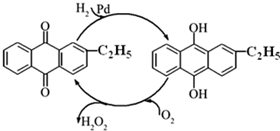 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是过氧化氢具有强氧化性.
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用图表示,此过程中与Pd起相同作用的物质为乙基蒽醌 (写名称).
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
①实验I、Ⅱ研究对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为1.0moL•L-1.
②三组实验中分解速率最慢的是Ⅰ(填编号).
m.过氧化氢含量的实验测定
兴趣小组同学用0.1000moL•L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(4)滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色.
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示.
计算试样中过氧化氢的浓度为0.180 moL•L-1 (保留三位有效数字).
 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是过氧化氢具有强氧化性.
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用图表示,此过程中与Pd起相同作用的物质为乙基蒽醌 (写名称).
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
②三组实验中分解速率最慢的是Ⅰ(填编号).
m.过氧化氢含量的实验测定
兴趣小组同学用0.1000moL•L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(4)滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色.
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
2.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)?N(g)+H2(g).
①该反应的平衡常数为1.该温度下,向容器中充入2molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正>V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是ABD.
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.8.
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
②结合表中数据判断下列说法中正确的是ABD.
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.8.
6.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 ,名称是2,2,3,3四甲基丁烷.
,名称是2,2,3,3四甲基丁烷.