题目内容
11.下列事实不能用勒夏特列原理解释的是( )| A. | 氯水中有下列平衡Cl2+H2O═HCl+HClO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 氨水中加入NaOH固体有利于氨气的溢出 | |
| D. | pH=1的盐酸加水稀释到原体积的100倍后,PH=3 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用,另外如是可逆反应,改变外界条件平衡不移动,则也不能用勒夏特列原理解释.
解答 解:A.氯水中有平衡:Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,生成AgCl沉淀,氯离子浓度降低,平衡向正向移动,能用勒夏特列原理解释,故A不选;
B、合成氨反应,降低温度平衡,正向移动,提高氨的产率,能用勒夏特列原理解释,故B不选;
C、氨水中加入NaOH固体,固体氢氧化钠与水溶解大量放热,其溶解平衡会逆向移动,能用勒夏特列原理解释,故C不选;
D、常温下pH=1的盐酸溶液中氢离子的浓度为0.1mol/L,稀释100倍后溶液中氢离子浓度为:1×10-3moll/L,稀释后溶液的pH为:pH=-lg[c(H+)]=-lg(10-3)=3,不能用勒夏特列原理解释,故D选.
故选D.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应,题中易错点为B,注意改变外界条件平衡不移动,则也不能用勒夏特列原理解释.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
1.下列说法正确的是( )
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(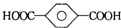 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (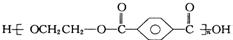 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
19.1mol甲烷和一定物质的量的氯气混合均匀,以漫射光照射使之发生取代反应.甲烷的取代反应所得有机产物都是很好的有机溶剂.假设反应后甲烷与氯气均无剩余,且生成了等物质的量的四种有机取代产物,则参加反应的氯气的物质的量为( )
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
6.用锌块与20mL3mol•L-1硫酸反应制取H2,若要增大反应速率,可采取的措施是①再加入20mL同浓度的稀硫酸 ②加入几滴CuSO4溶液 ③改用粉末状锌 ④适当升高温( )
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
16.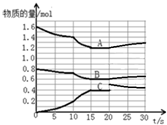 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
3.下列可能大量共存且溶液是无色的离子组是( )
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
20.将0.51 mol铜与250 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.待产生的气体全部释放后,向溶液中加入300 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是( )
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
14.下列污水处理过程,不涉及化学变化的是( )
| A. | 加入明矾净水 | B. | 过滤水中的不溶物 | ||
| C. | 调节水的pH | D. | 沉淀水中的Cu2+离子 |
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.