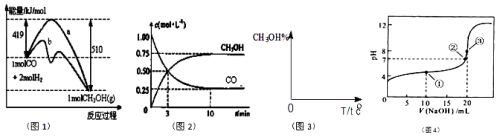
题目内容
4. 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:(1)体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至
1 000mL,稀释过程中溶液pH变化如图所示.则稀释后,HX溶液中水电离的c(H+)>醋酸溶液中水电离的c(H+);电离常数Ka(HX)>Ka(CH3COOH)(填“>”、“=”或“<”).
(2)已知KHC2O4溶液呈酸性.
①KHC2O4溶液中,各离子浓度由大到小的顺序是c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
②在KHC2O4溶液中,各粒子浓度关系正确的是CD.
A.c(C2O42-)<c(H2C2O4).
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)═c(C2O42-)+c(HC2O4-)+c(H2C2O4)
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol•L-1的Cr2O72-.为了使废水的排放达标,进行如下处理:Cr2O72-$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3
①该废水中加入绿矾和H+,发生反应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
②若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6mol•L-1.(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
分析 (1)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
(2)①已知KHC2O4溶液呈酸性,HC2O4-电离程度大于其水解程度,溶液显酸性;
②A.草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度;
B.KHC2O4溶液中,根据物料守恒可得:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),电荷守恒为:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),将钾离子浓度带入电荷守恒判断;
C.从溶液电中性的角度判断,溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
D.从溶液物料守恒来判断,n(K)=n(C);
(3)①酸性条件下,Cr2O72-具有强氧化性,可氧化Fe2+;
②废水中残留的c(Fe3+)=2.0×10-13 mol•L-1,可根据Ksp[Fe(OH)3]=4.0×10-38计算c(OH-),结合Ksp[Cr(OH)3]=6.0×10-31计算Cr3+的浓度.
解答 解:(1)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大,
故答案为:>;>;
(2)①已知KHC2O4溶液呈酸性,HC2O4-电离程度大于其水解程度,溶液显酸性,离子浓度大小为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
②在KHC2O4溶液中,
A.草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故A错误;
B.KHC2O4溶液中,根据物料守恒可得:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),电荷守恒为:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),将钾离子浓度带入电荷守恒可得:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-),即c(H2C2O4)+c(H+)-c(C2O42-)=c(OH-),故B错误;
C.溶液存在电荷守恒,则有c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故C正确;
D.在0.1mol•L-1KHC2O4溶液中,存在H2C2O4、C2O42-、HC2O4-和K+,根据物料守恒可知c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确;
故答案为:CD;
(3)①酸性条件下,Cr2O72-具有强氧化性,可氧化Fe2+,反应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
②若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31 ,c(Cr3+)=3×10-6mol•L-1;
故答案为:3×10-6mol•L-1.
点评 本题考查弱酸的电离及其影响因素、盐类水解的应用及其离子浓度的大小比较、氧化还原滴定、溶度积等知识,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意把握基础知识的运用,题目难度中等.

| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
①将
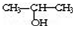 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②
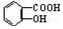 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备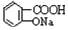
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
(1)N元素位于周期表第2周期VA族.
(2)用“>”、“<”或“=”填空:
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| Cl->Al3+ | 16O=18O | H2CO3>H2SiO3 | Cu<Al |
(4)写出MgCl2电子式:
 .
.(5)在${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg和${\;}_{29}^{65}$Cu中共有3种元素,6种核素.
| 原子组成 | Z | N | A |
| 3919K | 19 | 20 | 39 |
| 168O | 8 | 8 | 16 |
| 4018Ar | 18 | 22 | 40 |
| A. | 实验室应将钠保存在煤油中 | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 可用酒精代替CCl4萃取碘水中的碘单质 | |
| D. | 金属镁失火不可用水来灭火 |
| A. | CH3Cl | B. | CH3CH2OH | C. | CH2═CHBr | D. | CH2=CH2 |