题目内容
9.把5.6克的铁放入足量的稀硫酸中,铁完全反应.(已知铁的相对原子质量为56)计算:
(1)5.6克铁的物质的量;
(2)参加反应的硫酸的物质的量;生成气体的体积(标准状况).
分析 铁与稀硫酸反应生成硫酸亚铁与氢气;
(1)根据公式n=$\frac{m}{M}$,计算5.6gFe的物质的量;
(2)根据方程式中定量关系计算硫酸的物质的量和生成氢气.
解答 解:(1)5.6gFe的物质的量=$\frac{5.6g}{56g/mol}$=0.1mol,所以5.6gFe的物质的量为0.1mol,故答案为:0.1mol.
(2)设参加反应的硫酸的物质的量为xmol,生成氢气的体积为VL,则:
Fe+H2SO4 =FeSO4+H2↑;
1mol 1mol 22.4L
0.1mol xmol VL
所以$\frac{1mol}{0.1mol}=\frac{1mol}{xmol}=\frac{22.4L}{VL}$,
解得x=0.1mol; V=2.24L
即生成氢气体积为2.24L,
答:参加反应的硫酸的物质的量为:0.1mol;生成气体的体积为2.24L.
点评 本题考查根据方程式进行的计算,比较基础,侧重对学生基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
相关题目
6.下列变化中必须加入适当的氧化剂才能实现的是( )
| A. | MnO2→Mn2+ | B. | PCl3→PCl5 | C. | HCl→H2 | D. | SO2→SO32- |
17.下列说法中正确的是( )
| A. | 中子数为18的氯原子可表示为18Cl | |
| B. | 某金属阳离子的结构示意图为 ,其与Cl-形成的化合物都是离子化合物 ,其与Cl-形成的化合物都是离子化合物 | |
| C. | 二硫化碳的电子式为 | |
| D. | 17.4g熔融K2SO4与7.8 g熔融Na2O2中阴离子数目相同 |
14.下列叙述正确的是( )
| A. | CuSO4•5H2O属于纯净物 | B. | 纯碱、烧碱均属碱 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 盐类物质一定含有金属离子 |
1.已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4.一般而言,该式子中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
| A. | HClO3 | B. | H2SeO3 | C. | H3PO4 | D. | HMnO4 |
18.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的( )
| A. | NaOH固体 | B. | 同浓度的醋酸溶液 | ||
| C. | NH4Cl固体 | D. | CH3COONa固体 |
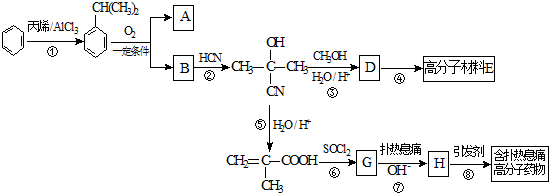
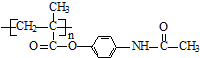 .
.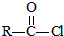
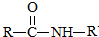 $\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2
$\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2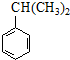 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
.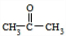 ;扑热息痛的结构简式为
;扑热息痛的结构简式为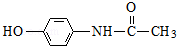 .
.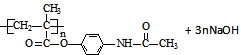 →
→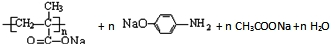 .
.