题目内容
下列用于解释实验事实的化学方程式正确的是( )
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-= Al(OH)3 
B.纯碱溶液使酚酞变红:CO32-+2H2O ?H2CO3+2OH-
C.乙酸清除水垢后的化学反应原理:2H++CO32-= CO2 + H2O
+ H2O
D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+
D
【解析】
试题分析:A.氨水中的一水合氨是弱碱,应该写化学式。Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3NH3·H2O= Al(OH)3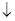 +3NH4+;错误;B.纯碱是强碱弱酸的盐,盐水解是分步进行的,溶液使酚酞变红:CO32-+2H2O ?HCO3-+OH-,错误;C.乙酸是弱酸,应该写化学式,清除水垢后的化学反应原理:2CH3COOH+CO32-= CO2
+3NH4+;错误;B.纯碱是强碱弱酸的盐,盐水解是分步进行的,溶液使酚酞变红:CO32-+2H2O ?HCO3-+OH-,错误;C.乙酸是弱酸,应该写化学式,清除水垢后的化学反应原理:2CH3COOH+CO32-= CO2 + H2O+2CH3COO-,错误;D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+,符合反应事实,离子方程式拆写也符合原则,正确。
+ H2O+2CH3COO-,错误;D.FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++ Fe=3Fe2+,符合反应事实,离子方程式拆写也符合原则,正确。
考点:考查离子方程式的正误判断的知识。

(20分)
(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________ 。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①H2SO4溶液: HSO4- | ②NaHSO4溶液: HSO4- | ③盐酸 HCl=H++Cl |
10% | 29% | 100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________ 。
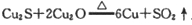 反应中,说法正确的是( )
反应中,说法正确的是( )
 10-8cm,则E的密度为______________________.
10-8cm,则E的密度为______________________.
 CO2(g)+H2(g)
CO2(g)+H2(g)
 CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________ (CO)=
(CO)= (CO)=_____;
(CO)=_____; (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”) H++SO42-
H++SO42-