题目内容
(14分)亚铁氰化钾(K4Fe(CN)6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下:

(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于 溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为 。
(3)流程图中加入碳酸钠溶液主要目的是 。
(4)相同温度下溶解度:Na4[Fe(CN)6] K4[Fe(CN)6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=□KCN+□Fe3C+□C+□(CN)2↑+□N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式 。
(每空均2分,共14分)(1)NaOH CN-+H2O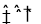 HCN+OH-
HCN+OH-
(2)K++ [Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;(3)除去其中的Ca2+
(4)>;(5)3K4Fe(CN)6= Fe3C + 12KCN +N2↑+C+2(CN)2↑
(6)2AgCl + [Fe(CN)6]4-= Fe2+ + [Ag2 (CN)6]4-+2Cl-
【解析】
试题分析:(1)NaCN是强碱弱酸盐,在溶液中溶液水解,使溶液显碱性。在实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于NaOH溶液,再用蒸馏水稀释,NaCN水解的离子方程式为
CN-+H2O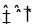 HCN+OH-;(2)实验室K4Fe(CN)6可用于检验Fe3+,检验Fe3+反应的离子方程式为K++ [Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;(3)由于在前边加入了CaCl2溶液,在溶液中含有大量的Ca2+会影响制取物质的纯度,为了除去溶液中的Ca2+,要加入碳酸钠溶液一形成CaCO3沉淀除去;(4)在溶液中含有大量的Na+、K+及[Fe(CN)6]-,可以形成K4[Fe(CN)6]沉淀而没有形成Na4[Fe(CN)6]沉淀,说明在相同温度下溶解度:Na4[Fe(CN)6] >K4[Fe(CN)6];(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,根据元素的原子守恒、电子守恒的知识,可得方程式是3K4Fe(CN)6= Fe3C + 12KCN +N2↑+C+2(CN)2↑;(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6], 根据元素的原子守恒及电荷守恒的知识可得:AgCl与黄血盐制取电镀液的离子方程式是2AgCl + [Fe(CN)6]4-= Fe2+ + [Ag2 (CN)6]4-+2Cl-。
HCN+OH-;(2)实验室K4Fe(CN)6可用于检验Fe3+,检验Fe3+反应的离子方程式为K++ [Fe(CN)6]4-+Fe3+=KFe[Fe(CN)6]↓;(3)由于在前边加入了CaCl2溶液,在溶液中含有大量的Ca2+会影响制取物质的纯度,为了除去溶液中的Ca2+,要加入碳酸钠溶液一形成CaCO3沉淀除去;(4)在溶液中含有大量的Na+、K+及[Fe(CN)6]-,可以形成K4[Fe(CN)6]沉淀而没有形成Na4[Fe(CN)6]沉淀,说明在相同温度下溶解度:Na4[Fe(CN)6] >K4[Fe(CN)6];(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,根据元素的原子守恒、电子守恒的知识,可得方程式是3K4Fe(CN)6= Fe3C + 12KCN +N2↑+C+2(CN)2↑;(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6], 根据元素的原子守恒及电荷守恒的知识可得:AgCl与黄血盐制取电镀液的离子方程式是2AgCl + [Fe(CN)6]4-= Fe2+ + [Ag2 (CN)6]4-+2Cl-。
考点:考查盐的水解的应用、Fe3+的检验、物质的溶解性的比较、离子方程式的书写的知识。

 53天天练系列答案
53天天练系列答案
 + H2O
+ H2O 化合物 + H2O”中,X不可能是
化合物 + H2O”中,X不可能是