题目内容
 工业上可以用金属镁和NaClO溶液制成“镁一次氯酸钠”燃料电池,其装置示意图如图所示,该电池反应的离子方程式为
工业上可以用金属镁和NaClO溶液制成“镁一次氯酸钠”燃料电池,其装置示意图如图所示,该电池反应的离子方程式为考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知“镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,依据得失电子守恒,原子个数守恒写成反应的离子方程式.
解答:
解:燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,
故答案为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓.
故答案为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓.
点评:本题考查了离子方程式的书写,明确原电池工作原理,找出放电物质和产物即可解答,注意电荷守恒、原子个数守恒.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g)△H=a kJ?mol-1其化学平衡常数K和温度t的关系如下表:下列说法中正确的是( )
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的正反应为吸热反应,即a<0 |
| B、当v正(H2)=v正(H2O)时该反应达到化学平衡状态 |
| C、当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 |
| D、当平衡浓度符合 c(CO2)?c(H2)=c(CO)?c(H2O)时的温度为830℃ |
下列有关金属的冶炼的说法正确的是( )
| A、高炉炼铁的过程是通过置换反应得到铁 |
| B、用电解氧化铝的方法冶炼得到铝 |
| C、高温加热氧化铜可以制单质铜 |
| D、硫化亚铜与氧气反应炼铜的过程不属于氧化还原反应 |
下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是( )
| A、加热Al2O3 |
| B、加热CaCO3 |
| C、电解熔融NaCl |
| D、氯化钠与铝粉高温共热 |
巴豆酸的结构简式为CH3-CH=CH-COOH,现有①氯化银 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸化的KMnO4溶液.试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是( )
| A、只有②④⑤ |
| B、只有①③④ |
| C、只有①②③④ |
| D、②③④⑤ |
含碳原子数为10或小于10的烷烃分子中,其一氯代烷不存在同分异构体的烷烃共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
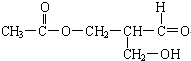 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?