��Ŀ����
5��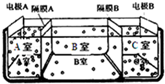 ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ���ش��������⣺
ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ���ش��������⣺��1��ˮ������ֱ��Ӱ�����彡������Ȼˮ�ھ������������м���Ļ����������������������������������������������������ʵ����ƣ����侻ˮ���õ�ԭ�������λ�������ˮ�з���ˮ��������Ӧ�������コ�壬����������Ȼˮ�������ﲢ�ƻ���Ȼˮ�е����������Ľ��壬ʹ��۳����ﵽ����Ŀ��
��2��ˮ�ľ�����������������ˮ�ľ������û��������������ȣ���ˮ�н��弰�����������������ˮ�������dz�ȥˮ�еĸ����Ӻ�þ����
��3��Ӳ��Ϊ1���ˮ��ָÿ��ˮ��10mg CaO����֮�൱�����ʣ���7.1mg MgO������ij��Ȼˮ��c��Ca2+��=1.2��10-3mol/L��c��Mg2+��=6��10-4mol/L�����ˮ��Ӳ��Ϊ10�㣮
��4������3���е���Ȼˮ������c��HCO3-��=8��10-4mol/L����Ҫ����10m3������Ȼˮ�������ȼ���Ca��OH��2740�ˣ������Na2CO31484�ˣ�
��5����ͼ�ǵ�������������ˮ��ԭ��ͼ�����У��缫A��ֱ����Դ���������缫B��ֱ����Դ�ĸ�����
�ٸ�ĤA����������������������ӽ���Ĥ��
��ij�ֺ�ˮ��Ʒ�����������д�����Na+��Cl-���Լ�������K+��SO42-����������װ�öԸú�ˮ���е�����������������ɺ�A��B��C������������Һ����Һ�壩��pH�ֱ�ΪpHa��pHb��pHc�������С˳��ΪpHa��pHb��pHc��
���� ��1��������������ˮ�����ɽ��壬������������ԣ�������ˮ�е���������ﵽ��ˮĿ�ģ�
��2������ˮ�dz�ȥ�������ʣ�����ˮ�dz�ȥ��þ���ӣ�
��3������Ӳ��Ϊ1���ˮ��ָÿ��ˮ��10mgCaO����֮�൱�����ʣ���7.1mgMgO������ˮ�е�Ca2+��Mg2+���������CaO����������õ���
��4��Ӳˮ������Ҫ�Ѹ����Ӻ�þ����ȫ�������������������ƺ�þ���ӡ�̼��������ӷ�Ӧ������̼���Ƴ��������ӣ�
��5�������ӽ���Ĥֻ��������������ͨ���������ӽ���Ĥֻ��������������ͨ�������ص������������ӷŵ磬���������������ӷŵ磮
��� �⣺��1��������������ˮ�е�С�������������۳ɽϴ�Ŀ����������ٳ�������Ҫ���ã�Ҫ�߱�ˮ�����ɽ�������ʣ����Գ������λ�������ˮ�з���ˮ��������Ӧ�������コ�壬���������������������������������ȣ�
�ʴ�Ϊ�������������������������������������λ�������ˮ�з���ˮ��������Ӧ�������コ�壬����������Ȼˮ�������ﲢ�ƻ���Ȼˮ�е����������Ľ��壬ʹ��۳����ﵽ����Ŀ�ģ�
��2��ˮ�ľ����dz�ȥ���������ʣ�һ�����������У�ˮ�������ǽ���Ca2+��Mg2+��Ũ�ȣ������ܶ࣬�����ӽ�������ʯ�Ҵ���ȣ�
�ʴ�Ϊ��ˮ�ľ������û��������������ȣ���ˮ�н��弰�����������������ˮ�������dz�ȥˮ�еĸ����Ӻ�þ���ӣ�
��3��ij��Ȼˮ��c��Ca2+��=1.2��10-3mol•L-1��c��Mg2+��=6��10-4mol•L-1��Ӳ��Ϊ1���ˮ��ָÿ��ˮ��10mgCaO����֮�൱�����ʣ���7.1mgMgO����1Lˮ�и��������ʵ���=1.2��10-3mol���൱��CaO����=1.2��10-3mol��56g/mol=67.2mg��1Lˮ��þ�������ʵ���=6��10-4mol���൱������þ����6��10-4mol��40g/mol=24mg������ˮ��Ӳ��=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10��ʴ�Ϊ��10�㣻
��4��10m3������Ȼˮˮ�к��и��������ʵ���=10��103L��1.2��10-3mol•L-1=12mol��þ�������ʵ���=10��103L��6��10-4mol•L-1=6mol��̼������������ʵ���=10��103L��8��10-4mol•L-1=8mol�������������Ʒ����ķ�ӦΪ��
Mg2++2OH-=Mg��OH��2�� HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
�������������ʵ���20mol��
��ҪCa��OH��2���ʵ���10mol��������������Ϊ74g/mol��10mol=740g��
ˮ��Һ��Ca2+���ʵ���Ϊ12mol+10mol=22mol��
������Ҫ����� ̼�������Ϊ22mol-8mol=14mol����Ҫ̼���Ƶ�����Ϊ14mol��106g/mol=1484g��
�ʴ�Ϊ��740��1484��
��5���������ӽ���Ĥֻ��������������ͨ���������ӽ���Ĥֻ��������������ͨ������ĤA�����������������������ӷŵ磬���Ը�ĤA�������ӽ���Ĥ���ʴ�Ϊ�������ӽ���Ĥ��
�ڵ��ص������������ӷŵ磬���������������ӷŵ磬��ĤA�������ӽ���Ĥ����ĤC�������ӽ���Ĥ������A�������ԣ�B�������ԣ�C���Լ��ԣ�����pH��С˳��Ϊ��pHa��pHb��pHc���ʴ�Ϊ��pHa��pHb��pHc��
���� ���⿼����ԭ����ˮ��Դ������Ӧ�ã�Ϊ��Ƶ���㣬��ȷ�����и����缫�����ķ�Ӧ������Ĥ�ص��ǽⱾ��ؼ����ѵ���Ӳ�ȵļ��㣬��Ŀ�Ѷ��еȣ�

| A�� | A-N-2 | B�� | A-N+2 | C�� | A+N-2 | D�� | A+N+2 |
| A�� | �������� | B�� | ���� | C�� | ���� | D�� | ֲ���� |
| A�� | �Ҵ������ѻ�Ϊͬ���칹�� | |
| B�� | ����ú���Եõ����顢���Ͱ�����Ҫ����ԭ�� | |
| C�� | �Ҵ�������֮���ܷ���������Ӧ��������Ӧ��������Ӧ��Ϊ�淴Ӧ | |
| D�� | �����������£�����ˮ��Ļ�ѧ����ʽΪ C12H22O11+H2O��2C6H12O6�������ǣ� |
| A�� | �ᴿ�������ʵĹ�ҵ�Ҵ������õķ��������� | |
| B�� | �����£���������̼ͨ�뱽������Һ����Һ������ | |
| C�� | ������ɳ�ı����ᣬ��ȥ���ʵķ����ǽ����ܽ����ˣ��������ᾧ���� | |
| D�� | ���ͱ���ϡ��Һ�ֱ���Ũ��ˮ��ϣ����߲�����ɫ���� |
| A�� | ���顢�Ҵ������ᶼ�������Ʒ�Ӧ�������� | |
| B�� | ʯ�ͷ���ɻ�ü��顢��ϩ������ | |
| C�� | ������ϩ������ʹ������Ȼ�̼��Һ��ɫ | |
| D�� |  ��֪�Ϻ������������Ա�־����֮-�Ϻ������ᣨ��ͼ�����ϲ����Ĥ�ṹETFE�ɵ�����ϩ���ķ���ϩ�Ӿ۶��ɣ���ṹ��ʽΪ�� 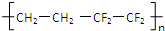 |
| A�� | ����ɫ��Ӧ�ɼ���NaCl��KCl | |
| B�� | ���������ڿ�ʴ������������SiO2��������������� | |
| C�� | ����ͨ����ˮ����ͭ����ĩ������֤��ԭ�����к���ˮ���� | |
| D�� | ��ʳƷ��װ���з���轺��ֹʳƷ���ʣ������ù轺����ˮ�� |
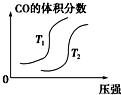
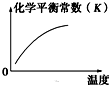
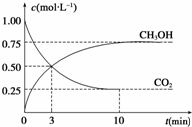 �»���2009��10��15�ձ�����ȫ��ũ��Ӧ���ڡ���ɫ��̬-�������-��̼����-ѭ����չ�������������£����ø���ط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺
�»���2009��10��15�ձ�����ȫ��ũ��Ӧ���ڡ���ɫ��̬-�������-��̼����-ѭ����չ�������������£����ø���ط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺