题目内容
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL5mol/L的稀硝酸,恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
| A、0.24 mol |
| B、0.21 mol |
| C、0.25 mol |
| D、0.14 mol |
考点:有关混合物反应的计算
专题:计算题
分析:硝酸恰好使Fe、FeO和Fe2O3的混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁,由铁元素守恒可知,足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答:
解:因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入120mL 5mol/L的稀硝酸,恰好使混合物完全溶解,所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,
2.24L NO(标准状况)的物质的量为
=0.1mol,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量=0.12L×5mol/L-0.1mol=0.5mol,所以硝酸亚铁的物质的量为
=0.25mol,
由铁元素守恒可知,用足量的氢气在加热下还原相同质量的混合物,得到铁的物质的量n(Fe)=0.25mol,
故选:C.
2.24L NO(标准状况)的物质的量为
| 2.24L |
| 22.4L/mol |
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量=0.12L×5mol/L-0.1mol=0.5mol,所以硝酸亚铁的物质的量为
| 0.5mol |
| 2 |
由铁元素守恒可知,用足量的氢气在加热下还原相同质量的混合物,得到铁的物质的量n(Fe)=0.25mol,
故选:C.
点评:本题考查混合物计算,关键是判断反应后溶液中的溶质为Fe(NO3)2,再利用原子守恒来计算,难度中等.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
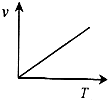
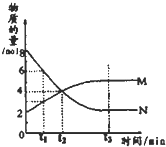 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t3后,若升高温度则反应速率增大 |
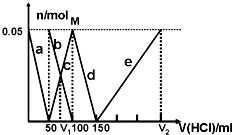 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| B、V1:V2=1:4 |
| C、M点时生成的CO2为0mol |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
元素周期表中某些元素之间存在特殊的对角关系:如 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )| A、Be常温下能与水反应 |
| B、Be(OH)2受热不会分解 |
| C、BeO易与水反应 |
| D、Be(OH)2能与强碱反应 |

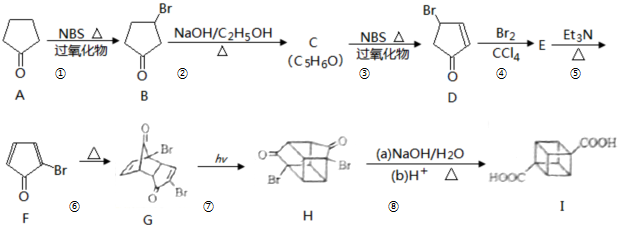
 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: