题目内容
元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用.下表(元素周期表前四周期的一部分)列出了①~⑧八种元素在周期表中的位置.

请回答:
(1)②所代表元素的名称为 ,原子结构示意图为 ,在周期表中的位置为 .
(2)八种元素中,金属性最强的元素是 (填元素符号),最高价氧化物的水化物酸性最强的是 (填化学式),最高正化合价与最低负化合价的代数和为4的元素是 (填元素符号).
(3)⑦和⑧的原子序数相差 ,请写出一个能证明非金属性⑦>⑧的离子方程式: .
(4)②、④、⑥所对应元素中原子半径最小的是 (填元素符号),简单离子半径最大的是 (填离子符号).

请回答:
(1)②所代表元素的名称为
(2)八种元素中,金属性最强的元素是
(3)⑦和⑧的原子序数相差
(4)②、④、⑥所对应元素中原子半径最小的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为N、②为O、③为F、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Br.
(1)②所代表元素为氧,原子核外电子数为8,有2个电子层,各层电子数为2、6,主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)同周期自左而右金属性减弱、非金属性增强,氟元素没有最高价含氧酸,故上述元素中,最高价氧化物的水化物酸性最强的是高氯酸;最高正化合价与最低负化合价的代数和为4,则元素处于Ⅵ族,注意氧元素没有最高正化合价;
(3)⑦和⑧的原子序数相差为⑧所在周期容纳元素种数;可以用单质之间的相互置换反应进行证明;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
(1)②所代表元素为氧,原子核外电子数为8,有2个电子层,各层电子数为2、6,主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)同周期自左而右金属性减弱、非金属性增强,氟元素没有最高价含氧酸,故上述元素中,最高价氧化物的水化物酸性最强的是高氯酸;最高正化合价与最低负化合价的代数和为4,则元素处于Ⅵ族,注意氧元素没有最高正化合价;
(3)⑦和⑧的原子序数相差为⑧所在周期容纳元素种数;可以用单质之间的相互置换反应进行证明;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答:
解:由元素在周期表中位置,可知①为N、②为O、③为F、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Br.
(1)②所代表元素为氧,原子核外电子数为8,有2个电子层,各层电子数为2、6,原子结构示意图为 ,主族元素周期数=电子层数、主族族序数=最外层电子数,故处于第二周期第ⅥA族,
,主族元素周期数=电子层数、主族族序数=最外层电子数,故处于第二周期第ⅥA族,
故答案为:氧; ;第二周期第ⅥA族;
;第二周期第ⅥA族;
(2)同周期自左而右金属性减弱、非金属性增强,故上述元素中Al的金属性最强,氟元素没有最高价含氧酸,故上述元素中,最高价氧化物的水化物酸性最强的是高氯酸,高氯酸化学式为HClO4;最高正化合价与最低负化合价的代数和为4,则元素处于Ⅵ族,由于氧元素没有最高正化合价,所以该元素为S,
故答案为:Al;HClO4;S;
(3)⑦和⑧的原子序数相差为⑧所在周期容纳元素种数,⑧位于第四周期,容纳18种元素,即二者原子序数形成18,可以用单质之间的相互置换反应进行证明,相应离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:18;Cl2+2Br-=2Cl-+Br2;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Al>S>O;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Al3+,
故答案为:O;S2-.
(1)②所代表元素为氧,原子核外电子数为8,有2个电子层,各层电子数为2、6,原子结构示意图为
 ,主族元素周期数=电子层数、主族族序数=最外层电子数,故处于第二周期第ⅥA族,
,主族元素周期数=电子层数、主族族序数=最外层电子数,故处于第二周期第ⅥA族,故答案为:氧;
 ;第二周期第ⅥA族;
;第二周期第ⅥA族;(2)同周期自左而右金属性减弱、非金属性增强,故上述元素中Al的金属性最强,氟元素没有最高价含氧酸,故上述元素中,最高价氧化物的水化物酸性最强的是高氯酸,高氯酸化学式为HClO4;最高正化合价与最低负化合价的代数和为4,则元素处于Ⅵ族,由于氧元素没有最高正化合价,所以该元素为S,
故答案为:Al;HClO4;S;
(3)⑦和⑧的原子序数相差为⑧所在周期容纳元素种数,⑧位于第四周期,容纳18种元素,即二者原子序数形成18,可以用单质之间的相互置换反应进行证明,相应离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:18;Cl2+2Br-=2Cl-+Br2;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Al>S>O;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Al3+,
故答案为:O;S2-.
点评:本题考查元素周期表与元素周期律,难度不大,注意掌握金属性与非金属性强弱比较及实验事实.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,相关数据如下
一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
A、如图可表示合成氨过程中的能量变化 |
| B、a的数值为391 |
| C、Q1的数值为92 |
| D、相同条件下,反应物若为2molN2和6molH2,放出热量Q2>2Q1 |
 短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )| A、元素X、Y的第一电离能:X<Y |
| B、简单离子半径:W>Q>Y>X |
| C、元素X的简单氢化物的空间构型为三角锥形 |
| D、元素W、Q的电负性:W>Q |
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多1,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的.下列推断中正确的是( )
| A、X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| B、Z的氧化物与水反应可制得相应的含氧酸 |
| C、X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
| D、Y的氧化物是两性氧化物,也是活泼金属氧化物,可以和水反应 |
常温下,pH值为11的NaOH溶液与pH值为11的CH3COONa溶液中,水电离的c(OH-)之比为( )
| A、1:1011 |
| B、1:103 |
| C、1:108 |
| D、108:1 |
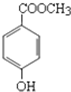 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为: 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.