题目内容
6.下列指定条件下的溶液中离子能够大量共存的是( )| A. | 强酸性溶液中:Na+、CO32-、NH4+、NO3- | |
| B. | 无色溶液中:Cl-、H+、Cu2+、SO42- | |
| C. | 使石蕊试液变蓝的溶液中:CO32-、Na+、MnO4-、K+ | |
| D. | 含SCN-的溶液中:K+、NH4+、Cl-、Fe3+ |
分析 A.强酸中含大量的氢离子;
B.Cu2+为蓝色;
C.使石蕊试液变蓝的溶液,显碱性;
D.离子之间结合生成络离子.
解答 解:A.强酸中含大量的氢离子,不能大量存在CO32-,故A错误;
B.Cu2+为蓝色,与无色不符,故B错误;
C.使石蕊试液变蓝的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.SCN-、Fe3+结合生成络离子,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、络合反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
16.已知苹果酸的结构简式为: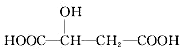 下列说法正确的是( )
下列说法正确的是( )
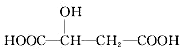 下列说法正确的是( )
下列说法正确的是( )| A. | 苹果酸分子中存在5种不同种类的氢原子 | |
| B. | 1mol苹果酸可与3mol NaOH完全中和 | |
| C. | 苹果酸与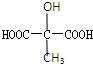 互为同分异构体 互为同分异构体 | |
| D. | 苹果酸分子中的所有碳原子可能处在同一条直线上 |
14.如图为铜丝与浓硫酸反应并验证其产物性质的实验装置.
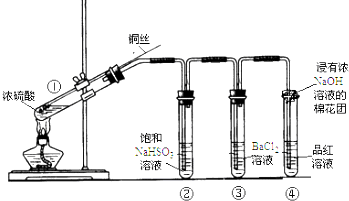
(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
完成上述反应的离子方程式.
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.

(1)①中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)②中饱和NaHSO3溶液的作用是除去除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,想要立即终止铜与硫酸的反应,最恰当的方法是a.
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(3)反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
(4)上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液过量,出现的现象是开始没有明显现象,后有蓝色沉淀生成.
11.将一定量的锌与浓度为18.5mol/L的100mL浓硫酸充分反应后,锌完全溶解,同时生成26.88L标准状况下的气体,反应后测得溶液中氢离子浓度为1.0mol/L,则生成的气体的物质的量之比为( )
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
18.4G网络让手机飞起来了.手机芯片的核心是硅板,其成分是( )


| A. | SiO2 | B. | Si | C. | H2Si03 | D. | Na2SiO3 |
15.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用10mL量筒量取9.2mL NaCl溶液 |

 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.