题目内容
11.合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂不改变反应的△H (填“增大”、“减小”或“不改变”).分析 恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动;
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变;
解答 解:恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动,该反应正反应是体积减小的反应,故平衡向左移动.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:向左;不改变;
点评 本题考查化学平衡影响因素问题,主要是恒温恒压条件下加入惰性气体,体积增大压强减小,题目较简单.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
2.化学与生产、生活密切相关.下列叙述中,不正确的是( )
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
3.下列说法正确的是( )
| A. | 酸式盐的水溶液一定显酸性 | |
| B. | 碳酸溶液中的氢离子浓度是碳酸根离子浓度的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
20.有一铁粉和氧化铜的混合物8.32g,进行如图实验.

根据实验所得数据,有关说法正确的是( )

根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
3.恒温恒容的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的N2O4(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
20.乙醇(C2H6O)的结构可能有两种 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
1.下列物质中,有极性共价键的是( )
| A. | 氯化镁 | B. | 过氧化钠 | C. | 单质碘 | D. | 水 |
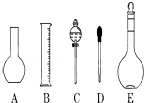 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: