题目内容
1.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号、化学式或化学用语回答以下问题:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3.
(3)⑤的单质与元素的最高价氧化物对应的水化物中碱性最强的碱溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
分析 由元素在周期表的位置可知,①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是Cl,⑧是Ar,⑨是K,⑩是Br.
(1)周期表中F的非金属性最强;
(2)高氯酸为所有含氧酸中酸性最强的酸,氢氧化铝具有两性;
(3)上述元素对应碱中,KOH的碱性最强,Al与KOH溶液反应生成偏铝酸钾和水;
(4)氯气比溴活泼,因氯气可置换出溴.
解答 解:由元素在周期表的位置可知,①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是Cl,⑧是Ar,⑨是K,⑩是Br.
(1)在这些元素中,非金属性最强的元素是F,故答案为:F;
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3,故答案为:HClO4;Al(OH)3;
(3)上述元素对应碱中,KOH的碱性最强,Al与KOH溶液反应生成偏铝酸钾和水,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用化学反应2NaBr+Cl2=2NaCl+Br2说明该事实,故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物及相关反应原理的应用,题目难度不大.

练习册系列答案
相关题目
9.下列各分子式只表示一种纯净物的是( )
| A. | CH2Br2 | B. | C4H8 | C. | C2H6O | D. | C5H10 |
11.X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
(1)X、W的化学式分别为NaOH、NH4NO3.
(2)HNO2在溶液中的电离方程式为HNO2?H++NO2-
(3)25℃时,W溶液的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)HNO2在溶液中的电离方程式为HNO2?H++NO2-
(3)25℃时,W溶液的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
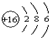 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2. .
.