题目内容
2.Al和Si、Ge和As在元素周期表的金属和非金属过渡位置上,其单质和化台物在建筑业、电子工业和石油化工等方面应用广泛.请回答下列问题:(1)As的价层电子构型为4s24p3.
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子的成键类型是共价键(或σ键).
(3)超高导热绝缘耐高温纳米材料氮化铝(AIN)在绝缘材料中的应用广泛,AIN晶体与金刚石类似,AIN属于原子晶体.
(4)SiCl4常用作烟雾剂,因为Si存在3d空轨道,能同H2O发生反应而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其反应原理SiCl4+3H2O=H2Si03↓+4HCl.
分析 (1)As为第四周期第ⅤA族元素;
(2)由信息可知,熔点较低,以分子形式存在;
(3)AlN晶体与金刚石类似,金刚石是原子晶体;
(4)由信息可知,SiCl4水解生成硅酸和HCl,以此来解答.
解答 解:(1)As为第四周期第ⅤA族元素,则价电子构型为4s24p3,故答案为:4s24p3;
(2)由信息可知,熔点较低,以分子形式存在,则属于分子晶体,所以Al、Cl之间以共价键结合,故答案为:共价键(或σ键);
(3)AlN晶体与金刚石类似,晶体类型与金刚石相同,为原子晶体,故答案为:原子;
(4)由信息可知,SiCl4水解生成硅酸和HCl,该反应为:SiCl4+3H2O=H2Si03↓+4HCl,故答案为:SiCl4+3H2O=H2Si03↓+4HCl.
点评 本题考查物质结构与性质,为高考常见考点,涉及价电子、化学键、晶体类型、水解等知识,综合性较强,注重学生知识迁移应用能力的培养,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 我国古代文献《天工开物》记载“凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测”是因为KNO3能自燃 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| D. | 运用荧光蛋白可以观测到细胞的活动,荧光蛋白是一种高分子化合物且能发生水解 |
17.氢有三种同位素:$\stackrel{1}{1}$H、$\stackrel{2}{1}$H和$\stackrel{3}{1}$H,它们之间存在差异的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 原子序数 |
14.硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有( )
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 范德华力 | ||||
| E. | 氢键 |
1.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号、化学式或化学用语回答以下问题:
(1)在这些元素中,非金属性最强的元素是F(填符号或化学式,下同),
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3.
(3)⑤的单质与元素的最高价氧化物对应的水化物中碱性最强的碱溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,呈两性的氢氧化物是Al(OH)3.
(3)⑤的单质与元素的最高价氧化物对应的水化物中碱性最强的碱溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
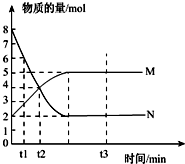 (1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: