题目内容
下列措施不能使0.1mol/L的醋酸溶液导电性增强的是( )
| A、加水 |
| B、加氯化钠晶体 |
| C、加NaOH固体 |
| D、通NH3 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:溶液导电能力与离子浓度成正比,不能使0.1mol/L的醋酸溶液导电性增强,说明改变条件后不能增大溶液中离子浓度,据此分析解答.
解答:
解:A.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,溶液中离子浓度降低,溶液的导电性减弱,故A正确;
B.加入NaCl晶体,氯化钠完全电离生成钠离子和氯离子,增大溶液中离子浓度,所以溶液导电性增强,故B错误;
C.加入NaOH固体,生成强电解质醋酸钠,促进醋酸电离,导致溶液中离子浓度增大,溶液导电性增强,故C错误;
D.通入氨气,氨气和醋酸反应生成醋酸铵,醋酸铵是强电解质,在水溶液里完全电离,导致溶液中离子浓度增大,溶液导电性增强,故D错误;
故选A.
B.加入NaCl晶体,氯化钠完全电离生成钠离子和氯离子,增大溶液中离子浓度,所以溶液导电性增强,故B错误;
C.加入NaOH固体,生成强电解质醋酸钠,促进醋酸电离,导致溶液中离子浓度增大,溶液导电性增强,故C错误;
D.通入氨气,氨气和醋酸反应生成醋酸铵,醋酸铵是强电解质,在水溶液里完全电离,导致溶液中离子浓度增大,溶液导电性增强,故D错误;
故选A.
点评:本题考查了弱电解质的电离,根据改变条件对溶液中离子浓度的影响分析解答,溶液导电能力只与离子浓度有关,与电解质强弱无关.

练习册系列答案
相关题目
在100mL 0.1mol/LCH3COOH溶液中,欲使CH3COOH电离度和溶液的pH都增大,可以采用的方法是( )
| A、加少量1 mol/L醋酸钠溶液 |
| B、加少量1 mol/L盐酸 |
| C、加100mL水 |
| D、加热 |
除去镁粉中含有的杂质铝粉可选用的溶液是( )
| A、硫酸 | B、氢氧化钠 |
| C、氨水 | D、氯化铜 |
下列工业制备的反应原理选择不恰当的是( )
A、制乙醇:CH3CHO+H2
| ||||
B、制盐酸:H2+Cl2
| ||||
C、制烧碱:2NaCl+2H2O
| ||||
| D、湿法冶炼铜:Fe+CuSO4=Cu+FeSO4 |
已知NH3极易溶于水,下列组合中不能形成喷泉的是( )
| A、HCl和H2O |
| B、O2和H2O |
| C、NH3和H2O |
| D、CO2和NaOH |
下列实验方案合理的是( )
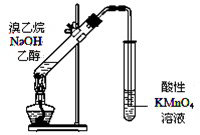

| A、鉴别苯和甲苯:分别加入溴水振荡 |
| B、检验酒精中的少量水:向酒精中加入无水硫酸铜 |
| C、制备纯净的氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置 |
金刚石、石墨物理性质不同的原因是( )
| A、组成的元素不同 |
| B、金刚石是单质,石墨是化合物 |
| C、碳原子结构不同 |
| D、碳原子的排列方式不同 |
实验操作的规范是实验的基本要求,下列实验操作正确的是( )
A、 检验容量瓶是否漏水 |
B、 给溶液加热 |
C、 滴加液体 |
D、 过滤 |