题目内容
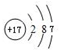
17. 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“.”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“.”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径不一定越大 | |
| B. | 图中直线相连的元素处于不是同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B两种元素组成的化合物中可能含有共价键 |
分析 O点代表氢元素,由“蜗牛”形状及原子序数可知,A为O元素,B为为Na元素,结合元素周期律来解答.
解答 解:A.离O点越远的元素原子半径不一定越大,电子层相同时原子序数大的原子半径小,故A正确;
B.图中直线相连的元素处于同一族,如H、Na位于第IA族,故B错误;
C.B为Na,为短周期金属性最强的元素,故C正确;
D.A、B两种元素组成的化合物中可能含有共价键,如Na2O2,故D正确;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构、元素周期律为解答的关键,侧重分析与应用能力的考查,注意D中过氧化钠含共价键,题目难度不大.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
7.用pH=1的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为x和y,则x和y的关系正确的是( )
| A. | x>y | B. | x<y | C. | x=y | D. | x≤y |
8.下列表示对应化学反应的离子方程式正确的是( )
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
12.某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)不相同.
(2)对实验3完成下列填空:
①石墨为正极,电极反应式:6H++6e-═3H2↑.
②电池总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极 (“负极”或“正极”),铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O,电池总反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)不相同.
(2)对实验3完成下列填空:
①石墨为正极,电极反应式:6H++6e-═3H2↑.
②电池总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极 (“负极”或“正极”),铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O,电池总反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
6.下列各组元素性质递变情况正确的是( )
| A. | Fe、Cu、Zn原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl第一电离能依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
 .
.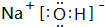 ,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程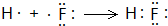 .
.
 .
.