题目内容
某校化学小组学生利用如图1所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
(1)装置B中发生反应的化学方程式是 .
(2)虚线框图C的气体收集装置是图2中的 (选填字母编号).
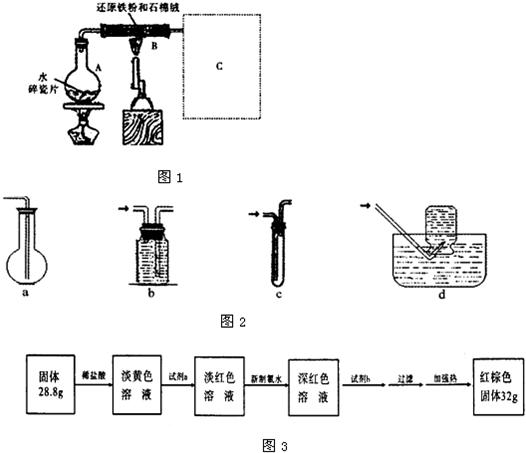
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g.再向固体中加入过量稀盐酸充分反应,并进行如图3实验:试剂a的化学式是 ,试剂b的化学式是 ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示) .
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究.首先提出假设.假设1:溶液中的+3价铁被氧化为更高的价态;假设2: ;为了对所提出的假设2进行验证,实验方案是 .
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为 .
(1)装置B中发生反应的化学方程式是
(2)虚线框图C的气体收集装置是图2中的

(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g.再向固体中加入过量稀盐酸充分反应,并进行如图3实验:试剂a的化学式是
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究.首先提出假设.假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为
考点:探究物质的组成或测量物质的含量,性质实验方案的设计
专题:实验设计题
分析:(1)装置B中,水蒸气和铁粉高温下发生氧化还原反应,生成Fe3O4和氢气;
(2)空气密度比空气小,如用排空气法收集,应用向下排空法,也可用排水法收集;
(3)得到固体质量为28.8g,加入过量稀盐酸充分反应,得到浅黄色溶液,应为FeCl3,加入试剂a变为淡红色,则加入的试剂为KSCN,加入新制备氯水,溶液颜色加深,说明Fe3+浓度增大,Fe2+被氯水氧化生成Fe3+,然后加入氢氧化钠溶液,可得到氢氧化铁固体,经过滤、加强热,可分解生成红棕色氧化铁固体;
(4)可取少量褪色后的溶液,再滴加过量KSCN溶液,如果出现红色,说明被KSCN氧化,反之+3价铁被氧化;
(5)红棕色固体为氧化铁,可根据质量计算.
(2)空气密度比空气小,如用排空气法收集,应用向下排空法,也可用排水法收集;
(3)得到固体质量为28.8g,加入过量稀盐酸充分反应,得到浅黄色溶液,应为FeCl3,加入试剂a变为淡红色,则加入的试剂为KSCN,加入新制备氯水,溶液颜色加深,说明Fe3+浓度增大,Fe2+被氯水氧化生成Fe3+,然后加入氢氧化钠溶液,可得到氢氧化铁固体,经过滤、加强热,可分解生成红棕色氧化铁固体;
(4)可取少量褪色后的溶液,再滴加过量KSCN溶液,如果出现红色,说明被KSCN氧化,反之+3价铁被氧化;
(5)红棕色固体为氧化铁,可根据质量计算.
解答:
解:(1)装置B中,水蒸气和铁粉高温下发生氧化还原反应,生成Fe3O4和氢气,方程式为3Fe+4H2O(g)
Fe3O4+4H2↑,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2↑;
(2)氢气难溶于水,可用排水法收集,bd为排水法,而氢气密度比空气小,a、c不能用于收集氢气,故答案为:bd;
(3)得到固体质量为28.8g,加入过量稀盐酸充分反应,得到浅黄色溶液,应为FeCl3,加入试剂a变为淡红色,则加入的试剂为KSCN,加入新制备氯水,溶液颜色加深,说明Fe3+浓度增大,Fe2+被氯水氧化生成Fe3+,方程式为2Fe2++Cl2=2Fe3++2Cl-,然后加入氢氧化钠溶液,可得到氢氧化铁固体,经过滤、加强热,可分解生成红棕色氧化铁固体,
故答案为:KSCN;NaOH;2Fe2++Cl2=2Fe3++2Cl-;
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,可能原因是+3价铁被氧化或SCN-被过量的氯水氧化,可取少量褪色后的溶液,再滴加过量KSCN溶液,如果出现红色,说明被KSCN氧化,反之+3价铁被氧化,
故答案为:SCN-被过量的氯水氧化;取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确;
(5)红棕色固体为氧化铁,质量为32g,则m(Fe)=
×32g=22.4g,ω(Fe)=
×100%=77.8%,故答案为:77.8%.
| ||
故答案为:3Fe+4H2O(g)
| ||
(2)氢气难溶于水,可用排水法收集,bd为排水法,而氢气密度比空气小,a、c不能用于收集氢气,故答案为:bd;
(3)得到固体质量为28.8g,加入过量稀盐酸充分反应,得到浅黄色溶液,应为FeCl3,加入试剂a变为淡红色,则加入的试剂为KSCN,加入新制备氯水,溶液颜色加深,说明Fe3+浓度增大,Fe2+被氯水氧化生成Fe3+,方程式为2Fe2++Cl2=2Fe3++2Cl-,然后加入氢氧化钠溶液,可得到氢氧化铁固体,经过滤、加强热,可分解生成红棕色氧化铁固体,
故答案为:KSCN;NaOH;2Fe2++Cl2=2Fe3++2Cl-;
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,可能原因是+3价铁被氧化或SCN-被过量的氯水氧化,可取少量褪色后的溶液,再滴加过量KSCN溶液,如果出现红色,说明被KSCN氧化,反之+3价铁被氧化,
故答案为:SCN-被过量的氯水氧化;取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确;
(5)红棕色固体为氧化铁,质量为32g,则m(Fe)=
| 56×2 |
| 56×2+16×3 |
| 22.4 |
| 28.8 |
点评:本题考查物质的含量测定以及性质实验方案的设计,为高考常见题型,题目以铁以及其化合物的相互转化为载体,侧重于实验方案设计与评价,题目难度中等,注意把握实验原理和实验目的.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列四支试管中,过氧化氢分解产生氧气的化学反应速率最大的是( )
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| A | 室温(25℃) | 12% | 有 |
| B | 水浴加热(50℃) | 4% | 无 |
| C | 水浴加热(50℃) | 12% | 有 |
| D | 室温( 25℃) | 4% | 无 |
| A、A | B、B | C、C | D、D |
某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是( )
| A、H2Y的电离方程式:H2Y?2H++Y2- |
| B、HY-的水解方程式:HY-+H2O?H3O++Y2- |
| C、该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+) |
| D、该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |


 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢) 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2 如图是常见仪器的部分结构.
如图是常见仪器的部分结构.