题目内容
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下试验:
(1)取样品a g,称取时使用的仪器名称为 .
(2)将样品溶于足量的稀盐酸中,过滤,滤液中主要含有 ,滤渣中含有 ,在溶解过滤时使用的玻璃仪器有 .
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式 .
(4)在第(3)步的滤液中通入足量CO2,过滤.有关反应的离子方程式是 .
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至沉淀不再减少为止,冷却后称量,质量为bg,有关反应的化学方程式 .原样品中铝的质量分数是 .
(6)若步骤(3)中加入氢氧化钠溶液的量不足,则实验结果 .(填”偏高”“偏低”或”无影响”)
(1)取样品a g,称取时使用的仪器名称为
(2)将样品溶于足量的稀盐酸中,过滤,滤液中主要含有
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式
(4)在第(3)步的滤液中通入足量CO2,过滤.有关反应的离子方程式是
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至沉淀不再减少为止,冷却后称量,质量为bg,有关反应的化学方程式
(6)若步骤(3)中加入氢氧化钠溶液的量不足,则实验结果
考点:探究物质的组成或测量物质的含量,常见金属元素的单质及其化合物的综合应用
专题:几种重要的金属及其化合物
分析:(1)使用托盘天平称取样品质量;
(2)铝与盐酸应生成氯化铝、Mg与盐酸反应生成氯化镁,单质硅和铜不能够和稀盐酸发生反应,留在了滤渣中;溶解、过滤过程需要仪器有:烧杯、漏斗、玻璃棒;
(3)剩余的盐酸与氢氧化钠反应生成氯化钠与水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,氯化铝与过量的氢氧化钠反应生成偏铝酸钠与氯化钠;
(4)过量二氧化碳与偏铝酸钠容易反应生成氢氧化铝沉淀与碳酸氢钠;
(5)所得沉淀为氢氧化铝,加热分解得到氧化铝与水;氧化铝中Al元素质量即为合金中Al的质量,进而计算Al的质量分数;
(6)氢氧化钠溶液不足,生成的氢氧化铝沉淀减少,测定结果偏低;没有洗涤沉淀,导致沉淀的质量偏大,测定生成的氧化铝质量偏大,测定结果偏高.
(2)铝与盐酸应生成氯化铝、Mg与盐酸反应生成氯化镁,单质硅和铜不能够和稀盐酸发生反应,留在了滤渣中;溶解、过滤过程需要仪器有:烧杯、漏斗、玻璃棒;
(3)剩余的盐酸与氢氧化钠反应生成氯化钠与水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,氯化铝与过量的氢氧化钠反应生成偏铝酸钠与氯化钠;
(4)过量二氧化碳与偏铝酸钠容易反应生成氢氧化铝沉淀与碳酸氢钠;
(5)所得沉淀为氢氧化铝,加热分解得到氧化铝与水;氧化铝中Al元素质量即为合金中Al的质量,进而计算Al的质量分数;
(6)氢氧化钠溶液不足,生成的氢氧化铝沉淀减少,测定结果偏低;没有洗涤沉淀,导致沉淀的质量偏大,测定生成的氧化铝质量偏大,测定结果偏高.
解答:
解:(1)使用托盘天平称取样品质量,故答案为:托盘天平;
(2)铝与盐酸应生成氯化铝、Mg与盐酸反应生成氯化镁,过滤,滤液中主要含有Al3+、Mg2+,单质硅和铜不能够和稀盐酸发生反应,留在了滤渣中;溶解、过滤过程需要仪器有:烧杯、漏斗、玻璃棒;
故答案为:Al3+、Mg2+;Cu、Si;烧杯、漏斗、玻璃棒;
(3)剩余的盐酸与氢氧化钠反应生成氯化钠与水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,氯化铝与过量的氢氧化钠反应生成偏铝酸钠与氯化钠,有关离子方程式为:H++OH-═H2O、Al3++4 OH-═AlO2-+2 H2O、Mg2++2 OH-═Mg(OH)2↓,
故答案为:H++OH-═H2O、Al3++4 OH-═AlO2-+2 H2O、Mg2++2 OH-═Mg(OH)2↓;
(4)过量二氧化碳与偏铝酸钠容易反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)所得沉淀为氢氧化铝,加热分解得到氧化铝与水,反应方程式为:2Al(OH)3
Al2O3+3 H2O,氧化铝中铝的质量为bg×
=
g,即为ag合金中Al的质量为
g,故合金中Al的质量分数=
×100%=
×100%,
故答案为:2Al(OH)3
Al2O3+3 H2O;
×100%;
(6)氢氧化钠溶液不足,生成的氢氧化铝沉淀减少,测定结果偏低,故答案为:偏低.
(2)铝与盐酸应生成氯化铝、Mg与盐酸反应生成氯化镁,过滤,滤液中主要含有Al3+、Mg2+,单质硅和铜不能够和稀盐酸发生反应,留在了滤渣中;溶解、过滤过程需要仪器有:烧杯、漏斗、玻璃棒;
故答案为:Al3+、Mg2+;Cu、Si;烧杯、漏斗、玻璃棒;
(3)剩余的盐酸与氢氧化钠反应生成氯化钠与水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,氯化铝与过量的氢氧化钠反应生成偏铝酸钠与氯化钠,有关离子方程式为:H++OH-═H2O、Al3++4 OH-═AlO2-+2 H2O、Mg2++2 OH-═Mg(OH)2↓,
故答案为:H++OH-═H2O、Al3++4 OH-═AlO2-+2 H2O、Mg2++2 OH-═Mg(OH)2↓;
(4)过量二氧化碳与偏铝酸钠容易反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)所得沉淀为氢氧化铝,加热分解得到氧化铝与水,反应方程式为:2Al(OH)3
| ||
| 54 |
| 102 |
| 9b |
| 17 |
| 9b |
| 17 |
| ||
| ag |
| 9b |
| 17a |
故答案为:2Al(OH)3
| ||
| 9b |
| 17a |
(6)氢氧化钠溶液不足,生成的氢氧化铝沉淀减少,测定结果偏低,故答案为:偏低.
点评:本题考查物质含量的测定,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列物质中,属于非电解质的是( )
| A、液态汞 | B、硫酸钡 |
| C、液氨 | D、浓硝酸 |
通过置换反应不可能生成( )
| A、FeCl2 |
| B、F2 |
| C、Al2O3 |
| D、C |
下列各组离子在酸性溶液中能大量共存的是( )
| A、Ag+、Na+、Cl-、NO3- |
| B、Na+、K+、OH-、SO42- |
| C、K+、Na+、CO32-、Cl- |
| D、Ba2+、Mg2+、NO3-、Cl- |

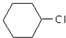
 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 为原料合成重要的化工产品
为原料合成重要的化工产品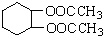 的路线流程图(无机试剂任选)合成路线流程图示例如图2.
的路线流程图(无机试剂任选)合成路线流程图示例如图2.