题目内容
17.将0.1mol的(A)Na; (B) Na2O; (C) Na2O2; (D) NaOH 各加入100mL水,充分搅拌,使固体全部溶解,则所得A,B,C,D溶液中溶质的质量分数按由小到大的顺序排列为( )| A. | A<B<C<D | B. | D<A<B=C | C. | A=B<C=D | D. | D<A<B<C |
分析 先根据反应方程式计算出反应后溶液的质量,然后根据钠原子守恒计算出溶质的物质的量及质量,最后根据w=$\frac{m(溶质)}{m(溶液)}$×100%计算出溶液的质量分数.
解答 解:钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+$\frac{1}{2}$H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;
所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol,
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得溶液的质量分数分别为:$\frac{4g}{100g+2.2g}$×100%、$\frac{8g}{100g+6.2g}$×100%、$\frac{8g}{100g+6.2g}$×100%、$\frac{4g}{100g+4g}$×100%,
所以A、B、C、D的质量分数大小的顺序是:D<A<B=C.
故选B.
点评 本题考查了钠及其化合物的性质、溶质质量分数的计算及比较,题目难度较大,明确溶液质量增加的量是解本题的关键,注意掌握钠及其化合物的性质及溶质的质量分数的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).原子结构示意图为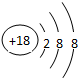 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: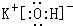 .
.
(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: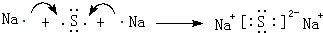 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦、①与⑥形成的化合物的电子式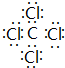 、
、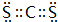 .
.
(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
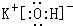 .
.(3)②的最高价氧化物的化学式为N2O5写出其最高价氧化物的水化物稀溶液与足量的铁粉反应的离子方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
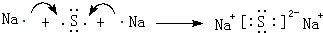 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦、①与⑥形成的化合物的电子式
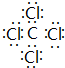 、
、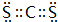 .
.(6)③、⑥氢化物的沸点高低H2O的沸点高于H2S;原因H2O分子之间存在氢键
(7)④、⑥、⑦形成的简单离子的半径大小S2->Cl->Na+
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%.该化合物的化学式为S4N4.
(9)④和③两种元素形成含有非极性键的化合物化学式为Na2O2,鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
5.在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | 2S(g)+O2(g)═2SO2(g);△H1 2S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
2.设NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温常压下,11.2 L CH4中含有的氢原子数为2NA | |
| B. | 1 mol Fe被氧化时,失去的电子数一定为2NA | |
| C. | 1 mol Na与足量水反应后转移的电子数为NA | |
| D. | 0.1 mol/L MgCl2溶液中Cl-离子数为0.2NA |
6.下列有关能量变化的说法中错误的是( )
| A. | 化学反应必伴随能量变化 | |
| B. | 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小 | |
| C. | Ba(OH)2•8H2O和NH4Cl(固体)混合搅拌发生的是吸热反应 | |
| D. | 键能越大物质能量越高,物质越稳定 |
7.下列有关中和热的说法正确的是( )
| A. | 中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 准确测量中和热的实验过程中,至少需测定温度4次 | |
| C. | 环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| D. | 若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确 |
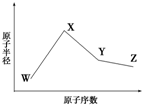 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的. 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: .
.