题目内容
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+ |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L |
| D、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-) |
考点:离子浓度大小的比较
专题:
分析:A.酸和碱等浓度等体积混合反应恰好反应生成盐,盐溶液显碱性证明,酸是弱酸,酸根离子水解;
B.依据溶液中电荷守恒、盐的水解原理分析判断;
C.依据混合后溶液pH=7 常温下呈中性时弱酸过量,结合溶液中物料守恒判断,注意混合液体积是混合前2倍;
D.根据混合液中的电荷守恒判断.
B.依据溶液中电荷守恒、盐的水解原理分析判断;
C.依据混合后溶液pH=7 常温下呈中性时弱酸过量,结合溶液中物料守恒判断,注意混合液体积是混合前2倍;
D.根据混合液中的电荷守恒判断.
解答:
解:A.将0.1mol/L的一元酸HA的溶液和0.1mol/L的KOH溶液等体积混合,恰好反应生成KA盐溶液,溶液的pH=9,说明溶液呈碱性,则c(OH-)>c(H+),HA为弱酸,溶液中A-离子部分水解,则:c(K+)>c(A-),所以溶液中离子浓度大小为c(K+)>c(A-)>c(OH-)>c(H+),故A正确;
B.混合后溶液pH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),所以反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+),故B正确;
C.混合后溶液pH=7 常温下呈中性,则弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A-)+c(HA)>
mol/L=0.1 mol/L,故C正确;
D.根据电荷守恒可得:c(K+)+c(H+)=c(OH-)+c(A-),则c(OH-)=c(K+)+c(H+)-c(A-),故D错误;
故选D.
B.混合后溶液pH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),所以反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+),故B正确;
C.混合后溶液pH=7 常温下呈中性,则弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A-)+c(HA)>
| 0.2 |
| 2 |
D.根据电荷守恒可得:c(K+)+c(H+)=c(OH-)+c(A-),则c(OH-)=c(K+)+c(H+)-c(A-),故D错误;
故选D.
点评:本题考查了电解质溶液中离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,能够根据电荷守恒、物料守恒、质子守恒、盐的水解原理等知识判断溶液中离子浓度大小,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
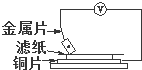 将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 电流方向 | 电压/V |
| A | Cu→A | +0.78 |
| B | B→Cu | -0.30 |
| C | Cu→C | +1.35 |
| D | Cu→D | +0.15 |
| A、金属性由强到弱的顺序为:C>A>B>D |
| B、金属B不能从CuSO4溶液中置换出单质铜 |
| C、放金属C时铜片上发生的反应为:Cu-2e-=Cu2+ |
| D、金属D表面反应为:O2+2H2O+4e-=4OH- |
下列说法正确的是( )
| A、血红蛋白、牛胰岛素、蚕丝、人造奶油充分水解后均可得到氨基酸 |
| B、李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法 |
| C、测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振谱、同位素示踪法等 |
| D、色谱法通常用于分离结构相近、物理性质和化学性质相似的物质.纸层析法就是一种简单的色谱分析法 |
一种瑞香素的衍生物的结构简式如图,下列有关该有机物性质的说法正确的是( )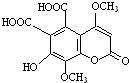

| A、能与FeCl3溶液发生显色反应 |
| B、1mol该有机物最多可与3molH2加成 |
| C、1mol该有机物最多可与含5molNaOH的溶液反应 |
| D、1mol该有机物与足量NaHCO3溶液反应可放出3molCO2 |
下列基本操作正确的是( )
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| B、用燃着的酒精灯去点燃另一盏酒精灯 |
| C、用天平称取药品时用手直接拿砝码 |
| D、用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2的体积为5.6L |
| B、标准状况下,22.4LCCl4所含的分子数为NA |
| C、标准状况下,1.8gH2 O中含有电子数为NA |
| D、常温常压下,10g氖气含有的原子数为NA |
设阿伏加德罗常数为NA.则下列说法正确的是( )
| A、0.1 mo1?L-1稀硫酸100mL中含有硫酸根的个数为0.1NA | ||
B、1 cm3铁所含的铁原子数是
| ||
| C、常温下,2.7g 铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | ||
| D、2.24L CO2与足量的Na2O2转移的电子总数可能为0.1NA |
关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯
②它们的氧化物都只有M20和M202两种形式
③在自然界中均以化合态形式存在
④密度按Li-Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+.
①金属性最强的是铯
②它们的氧化物都只有M20和M202两种形式
③在自然界中均以化合态形式存在
④密度按Li-Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+.
| A、①②③ | B、①③④⑤ |
| C、②④⑤ | D、①③⑤ |
25℃时,0.1mol?L-1下列溶液的pH如下表,有关比较错误的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A、酸的强度:HF>H2CO3 |
| B、由水电离产生的c(H+):①=② |
| C、溶液中酸根离子浓度:c(F-)>c(HCO3-) |
| D、序号④中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol?L-1 |