题目内容
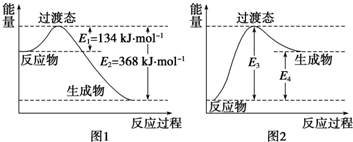
3.碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述不正确的是( )| A. | 反应物分子必须碰撞才有可能发生反应 | |
| B. | 反应速率大小与单位时间内反应物分子间的碰撞次数成正比 | |
| C. | 有效碰撞是活化分子在一定方向上的碰撞 | |
| D. | 活化分子的平均能量称为活化能 |
分析 A.反应物分子必须碰撞才能发生接触;
B.单位时间内反应物分子间的碰撞次数越多,反应速率越大;
C.只有活化分子间有合适的取向、发生的碰撞才能发生化学反应;
D.使普通分子变成活化分子所需提供的最低限度的能量叫活化能.
解答 解:A.反应物分子必须碰撞才能发生接触,必须碰撞才有可能发生反应,故A正确;
B.单位时间内反应物分子间的碰撞次数越多,反应速率越大,故B正确;
C.只有活化分子间有合适的取向、发生的碰撞才能发生化学反应,故C正确;
D.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,活化分子的平均能量与所有分子的平均能量之差称为活化能,故D错误.
故选D.
点评 本题考查活化能与焓变,为高频考点,侧重于学生的分析能力的考查,注意把握有效碰撞、活化能等知识,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
12.下列叙述中,正确的是( )
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定完全相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子如果核外电子排布相同,则一定具有相同的中子数 | |
| D. | 某离子M层和L层上的电子均为K层的4倍 |
14.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 热稳定性:HF>HI>HBr>HCl | |
| D. | 熔点由高到低:NaF>NaCl>NaBr>NaI |
18.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性 的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
15.下列说法正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质溶液不一定比弱电解质的导电性强 | |
| C. | HR型共价化合物一定是强电解质 | |
| D. | 强、弱电解质的导电性只由它们溶液的浓度决定 |
12.下列变化不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 合成氨是放热反应,采用在较高温度下进行反应 | |
| D. | 实验室用排饱和食盐水的方法收集氯气 |
13.Se是人体必需微量元素,下列有关${\;}_{34}^{78}$ Se和 ${\;}_{34}^{80}$Se的说法正确的是( )
| A. | ${\;}_{34}^{78}$ Se 和${\;}_{34}^{80}$Se所含电子数不同 | |
| B. | ${\;}_{34}^{78}$Se和 ${\;}_{34}^{80}$Se都含有34个中子 | |
| C. | ${\;}_{34}^{78}$ Se和${\;}_{34}^{80}$ Se 分别含有44和46个质 | |
| D. | ${\;}_{34}^{78}$ Se和${\;}_{34}^{80}$Se互为同位素 |
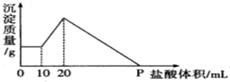 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示: