题目内容
某无色透明溶液中,可能含有以下离子中的若干种:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、CO32-、I-和Cl-,取该溶液进行如下实验:
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.根据以上现象判断原溶液中( )
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.根据以上现象判断原溶液中( )
| A、②中无色气体中有NO,可能含CO2 |
| B、③中沉淀有BaSO4,可能含BaCO3 |
| C、肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是 Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+、Cl- |
| D、②中红棕色气体通入水中发生反应的离子方程式为:3NO2+H2O=H++NO3-+2NO |
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:无色透明溶液中,一定不存在有色的离子:Fe2+;
①将溶液滴在pH试纸上,呈红色,说明溶液显示酸性,则不存在CO32-;
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色,该无色气体为NO,原溶液中一定存在NO3-,溶液具有氧化性,则一定不存在具有还原性的I-;
③取少许溶液滴入BaCl2试液,则产生白色沉淀,该白色沉淀为硫酸钡,则溶液中一定存在SO42-,一定不存在Ba2+;
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀,由于引进了氯离子,无法确定原溶液中是否含有Cl-;
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解,说明溶液中一定存在Mg2+,Al3+;
根据以上分析进行解答.
①将溶液滴在pH试纸上,呈红色,说明溶液显示酸性,则不存在CO32-;
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色,该无色气体为NO,原溶液中一定存在NO3-,溶液具有氧化性,则一定不存在具有还原性的I-;
③取少许溶液滴入BaCl2试液,则产生白色沉淀,该白色沉淀为硫酸钡,则溶液中一定存在SO42-,一定不存在Ba2+;
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀,由于引进了氯离子,无法确定原溶液中是否含有Cl-;
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解,说明溶液中一定存在Mg2+,Al3+;
根据以上分析进行解答.
解答:
解:无色透明溶液中,一定不存在有色的离子:Fe2+;
①将溶液滴在pH试纸上,呈红色,说明溶液显示酸性,则不存在CO32-;
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色,该无色气体为NO,原溶液中一定存在NO3-,溶液具有氧化性,则一定不存在具有还原性的I-;
③取少许溶液滴入BaCl2试液,则产生白色沉淀,该白色沉淀为硫酸钡,则溶液中一定存在SO42-,一定不存在Ba2+;
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀,由于引进了氯离子,无法确定原溶液中是否含有Cl-;
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解,说明溶液中一定存在Mg2+,Al3+;
综上知道:溶液中一定存在SO42-、Mg2+,Al3+、NO3-,一定不存在I-、Ba2+、Fe2+、CO32-,无法确定原溶液中是否含有Cl-、K+.
A、溶液中一定存在SO42-、Mg2+,Al3+、NO3-,一定不存在CO32-;将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色,该气体一定是NO,不可能含CO2,故A错误;
B、溶液中一定不存在CO32-,③中沉淀有BaSO4,不可能含BaCO3,故B错误;
C、溶液中一定存在SO42-、Mg2+,Al3+、NO3-,一定不存在I-、Ba2+、Fe2+、CO32-;无法确定原溶液中是否含有Cl-、K+,故C正确;
D、红棕色气体二氧化氮通入水中发生反应的离子方程式为:3NO2+H2O=2H++2NO3-+NO↑,故D错误.
故选C.
①将溶液滴在pH试纸上,呈红色,说明溶液显示酸性,则不存在CO32-;
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色,该无色气体为NO,原溶液中一定存在NO3-,溶液具有氧化性,则一定不存在具有还原性的I-;
③取少许溶液滴入BaCl2试液,则产生白色沉淀,该白色沉淀为硫酸钡,则溶液中一定存在SO42-,一定不存在Ba2+;
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀,由于引进了氯离子,无法确定原溶液中是否含有Cl-;
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解,说明溶液中一定存在Mg2+,Al3+;
综上知道:溶液中一定存在SO42-、Mg2+,Al3+、NO3-,一定不存在I-、Ba2+、Fe2+、CO32-,无法确定原溶液中是否含有Cl-、K+.
A、溶液中一定存在SO42-、Mg2+,Al3+、NO3-,一定不存在CO32-;将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色,该气体一定是NO,不可能含CO2,故A错误;
B、溶液中一定不存在CO32-,③中沉淀有BaSO4,不可能含BaCO3,故B错误;
C、溶液中一定存在SO42-、Mg2+,Al3+、NO3-,一定不存在I-、Ba2+、Fe2+、CO32-;无法确定原溶液中是否含有Cl-、K+,故C正确;
D、红棕色气体二氧化氮通入水中发生反应的离子方程式为:3NO2+H2O=2H++2NO3-+NO↑,故D错误.
故选C.
点评:本题考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及正确的检验方法,明确在检验离子存在时,必须排除干扰离子,保证实验方案的严密性.

练习册系列答案
相关题目
 某溶液中可能含有H+、NH4+、Na+、Mg2+、Al3+、Fe2+、CI-、CO32-、NO3-中的几种.①若加入锌粒,产生无色无味的氢气;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.回答下列问题:
某溶液中可能含有H+、NH4+、Na+、Mg2+、Al3+、Fe2+、CI-、CO32-、NO3-中的几种.①若加入锌粒,产生无色无味的氢气;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.回答下列问题: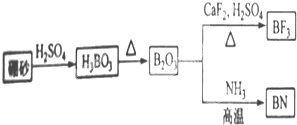
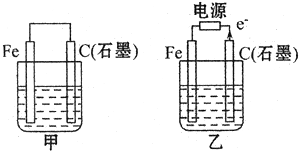 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液.