题目内容
16.在一定温度下,对于已达到化学平衡的反应2A(g)+B(s)?C(g)+D(g),△H<0,下列有关说法正确的( )| A. | 增加A 的量,平衡不移动 | |
| B. | 增加B 的量,平衡正向移动 | |
| C. | 升高体系温度,平衡常数K 增大 | |
| D. | 压缩气体体积,正、逆反应速率均增大,平衡不移动 |
分析 2A(g)+B(s)?C(g)+D(g),△H<0,正反应为放热反应,升高温度,平衡逆向移动,B为固体,反应前后气体的物质的量不变,增大压强,平衡不移动,以此解答该题.
解答 解:A.增加A 的量,反应物浓度增大,平衡正向移动,故A错误;
B.B为固体,加B 的量,平衡不移动,故B错误;
C.升高温度,平衡逆向移动,则平衡常数减小,故C错误;
D.反应前后气体的物质的量不变,增大压强,平衡不移动,但反应速率增大,故D正确.
故选D.
点评 本题考查化学平衡的影响因素,为高频考点,侧重考查学生的分析能力,题目难度不大,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.分析图中各项的排布规律,请推测第10列有机物的分子式为( )


| A. | C50H80 | B. | C50H82 | C. | C50H84 | D. | C50H86 |
11.下列物质分类的正确组合是( )
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨 | 食盐 |
| B | 水玻璃 | KNO3晶体 | O2 | 纯碱(Na2CO3) |
| C | 空气 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4•5H2O | CaCl2 | 水银 | CaO |
| A. | A | B. | B | C. | C | D. | D |
2.现有部分元素的性质与原子(或分子)结构如表:
(1)X形成的双原子分子的结构式为O=O,X形成的氢化物的沸点在同族元素形成的氢化物中是最高(填“最高”或“最低”),原因是水分子间存在氢键.
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是SO2(填化学式),检验该气体的常用试剂品红溶液.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是SO2(填化学式),检验该气体的常用试剂品红溶液.
19.下列冇关实验方法或操作正确的( )
| A. |  喷泉实验 | B. |  氯气除杂 氯气除杂 | C. |  分离汽油和水 | D. |  丁达尔效应 |
20.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
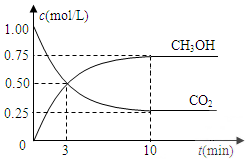 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.