题目内容
有机物A的结构简式为:
(1)A的分子式为 .
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物.当有1mol A发生反应时,最多消耗 mol NaOH.
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为 .
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体. .

(1)A的分子式为
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物.当有1mol A发生反应时,最多消耗
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体.
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:(1)由结构简式确定有机物含有的元素种类和原子数目,可确定有机物分子式;
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,则B为 ,D为
,D为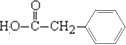 ;
;
(3)B为 ,含有羧基和羟基,可发生酯化反应;
,含有羧基和羟基,可发生酯化反应;
(4)形成的酯可为苯甲酸甲酯、乙酸苯酚酯以及甲酸苯甲醇酯.
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,则B为
 ,D为
,D为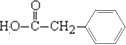 ;
;(3)B为
 ,含有羧基和羟基,可发生酯化反应;
,含有羧基和羟基,可发生酯化反应;(4)形成的酯可为苯甲酸甲酯、乙酸苯酚酯以及甲酸苯甲醇酯.
解答:
解:(1)由结构简式可知A的分子式为C12H13O4Cl,故答案为:C12H13O4Cl;
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,则B为 ,D为
,D为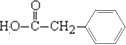 ,
,
A中含有羧基,可与氢氧化钠发生中和反应,含有酯基和Cl原子,水解生成羧基和HCl,则1molA发生反应时,最多消耗3mol NaOH,
故答案为:3;
(3)B为 ,含有羧基和羟基,可发生酯化反应,形成五元环的结构简式为
,含有羧基和羟基,可发生酯化反应,形成五元环的结构简式为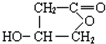 ,
,
故答案为: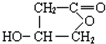 ;
;
(4)D为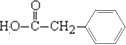 ,对应的同分异构体中,形成的酯可为苯甲酸甲酯、乙酸苯酚酯以及甲酸苯甲醇酯,结构简式分别为
,对应的同分异构体中,形成的酯可为苯甲酸甲酯、乙酸苯酚酯以及甲酸苯甲醇酯,结构简式分别为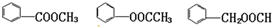 ,
,
故答案为: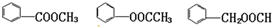 .
.
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,则B为
 ,D为
,D为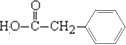 ,
,A中含有羧基,可与氢氧化钠发生中和反应,含有酯基和Cl原子,水解生成羧基和HCl,则1molA发生反应时,最多消耗3mol NaOH,
故答案为:3;
(3)B为
 ,含有羧基和羟基,可发生酯化反应,形成五元环的结构简式为
,含有羧基和羟基,可发生酯化反应,形成五元环的结构简式为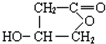 ,
,故答案为:
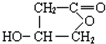 ;
;(4)D为
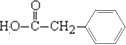 ,对应的同分异构体中,形成的酯可为苯甲酸甲酯、乙酸苯酚酯以及甲酸苯甲醇酯,结构简式分别为
,对应的同分异构体中,形成的酯可为苯甲酸甲酯、乙酸苯酚酯以及甲酸苯甲醇酯,结构简式分别为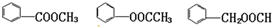 ,
,故答案为:
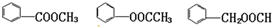 .
.
点评:本题考查有机物结构和性质,为高频考点,题目难度不大,注意把握有机物官能团的性质,为解答该类题目的关键.

练习册系列答案
相关题目
化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A、处理废弃塑料制品较为合理的方法是使用化学方法把它加工成防水涂料或汽油等物质 |
| B、研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染 |
| C、新型材料聚酯纤维、光导纤维都属于有机高分子 |
| D、工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染 |
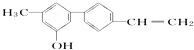 某有机化合物的结构简式如图所示关于该化合物的下列说法正确的是( )
某有机化合物的结构简式如图所示关于该化合物的下列说法正确的是( )| A、由于含有氧元素不是有机物 |
| B、该物质在一定条件下最多和1mol H2发生反应 |
| C、分子中苯环上连有羟基属于酚 |
| D、不能使溴水褪色 |

 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.