题目内容
15.在常温常压下,取下列四种有机物个1mol分别在足量的氧气中燃烧,消耗氧气最多的是( )| A. | CH4 | B. | C2H5OH | C. | C3H8O | D. | C3H8O2 |
分析 令选项中各有机物的通式为CxHyOz,燃烧通式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2→xCO2+$\frac{y}{2}$H2O,则1mol有机物的耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,据此计算判断.
解答 解:令选项中各有机物的通式为CxHyOz,燃烧通式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)molO2→xCO2+$\frac{y}{2}$H2O,
A.1molCH4的耗氧量=(1+1)mol=2mol;
B.1molC2H6O的耗氧量=(2+$\frac{6}{4}$-$\frac{1}{2}$)mol=3mol;
C.1molC3H8O的耗氧量=(3+$\frac{8}{4}$-$\frac{1}{2}$)mol=4.5mol;
D.1molC3H8O2的耗氧量=(3+$\frac{8}{4}$-$\frac{2}{2}$)mol=4mol;
故相同物质的量,C消耗氧气最多.
故选C.
点评 本题考查有机物耗氧量的计算,题目难度不大,注意有机物燃烧的化学方程式的书写以及通式的利用.

练习册系列答案
相关题目
6.下列说法中错误的是( )
| A. | 符合通式CnH2n+2(n≥1)且相对分子质量不相等的有机物为同系物 | |
| B. | 符合同一通式且相对分子质量不相等的有机物为同系物 | |
| C. | 乙醇和甲醚不是同系物但不同分异构体 | |
| D. | CH3CH2CHO、CH2=CHCH2OH、二种物质互为同分异构体 |
3.已知C-C键可以绕键轴自由旋转,结构简式如图所示的烃,下列说法中正确的是( )


| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该物质的核磁共振氢谱上共有8个峰 | |
| D. | 该烃是苯的同系物 |
20.下列有机物可在厨房中作调味剂的是( )
| A. | 甘油 | B. | 醋酸 | C. | 淀粉 | D. | 汽油 |
7.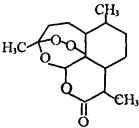 2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )
 2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素能与碳酸氢钠溶液反应生成二氧化碳 | |
| B. | 青蒿素分子有7个手性碳原子 | |
| C. | 青蒿素在一定条件下能与NaOH溶液反应 | |
| D. | 青蒿素是脂溶性的 |
16.下列反应所得溶液中一定只含有一种溶质的是( )
| A. | 向稀硝酸中加入铁粉 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向NaOH溶液中通入CO2气体 | |
| D. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 |
 .
. 、
、 ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
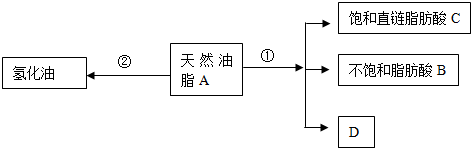
.
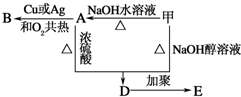
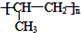 .
.