题目内容
5.已知5种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子,完成下列问题:(1)写出5种元素的名称:A钠,B氧,C硫,D氮,E氢.
(2)用电子式表示离子化合物A2B的形成过程:
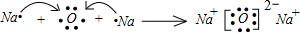 .
.(3)写出D元素形成的单质的结构式:N≡N.
(4)写出下列物质的电子式:E与B形成的化合物
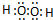 、
、 ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物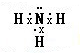 .
.
分析 五种短周期元素的原子序数的大小顺序为C>A>B>D>E,A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30,则离子含有的电子数为10,由A2B可知,A离子为+1价离子,B离子为-2价离子,则A为钠元素,B为氧元素;B、C同主族,则C为硫元素;D和E可形成四核10电子分子,则D为氮元素,E为氢元素,由此分析解答.
解答 解:A与B形成离子化合物A2B,A2B中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3,结合原子序数D>E,可知D是N元素,E是H元素,
(1)由上述分析可知,A为Na,B为O,C为S,D为N,E为H,
故答案为:钠;氧;硫;氮;氢;
(2)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为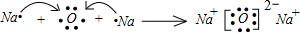 ,
,
故答案为: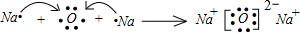 ;
;
(3)D为氮元素,单质中氮原子之间形成3对共用电子对,结构式为N≡N,故答案为:N≡N;
(4)E与B形成的化合物为H2O2和H2O,氢原子与氧原子之间形成1对共用电子对,氧原子与氧原子之间形成1对共用电子对,电子式为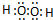 ,水的电子式为
,水的电子式为 ;A、B、E形成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为
;A、B、E形成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为 ;
;
D、E形成的化合物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为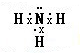 ;
;
故答案为: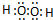 、
、 ;
; ;
;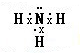 .
.
点评 以元素推断为载体,考查结构位置关系、电子式等化学用语、晶体类型与化学键,难度不大,推断元素是解题关键,注意基础知识的掌握与运用,是对学生能力的综合考查.

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案| A. | I2O5 | B. | I2O4 | C. | I4O5 | D. | I4O9 |
| A. | 达到化学平衡时,有2molNH3生成 | |
| B. | 达到化学平衡时,正反应和逆反应的速率均为零 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量不再变化 | |
| D. | 达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 |
| 化学键 | H-H | O=O | H-O |
| 键能(KJ/mol) | 436 | 496 | 463 |
| A. | 242 | B. | -242 | C. | 484 | D. | -484 |

| A. | 空/燃比的增大使氧气的浓度增大,因而CO、CxHy的含量会慢慢变小 | |
| B. | 当空/燃比达到15后由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故NOx减少 | |
| C. | 空/燃比的增大,燃烧产生的高温及火花塞放电能促使空气中的氮气与氧气直接生成NO2 | |
| D. | 在机动车尾气出口处使用催化剂能将CO、NOx转化为无害的N2和CO2 |
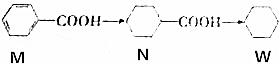
下列说法正确的是( )
| A. | 浓硫酸加热的条件下,1mol M与1mol CH3CH2OH混合,可生成1mol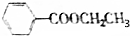 | |
| B. | 等质量的M、N、W分别在氧气中完全燃烧,W的耗氧量最大 | |
| C. | N的一氯代物有3种同分异构体(不考虑立体异构) | |
| D. | W分子中所有碳原子一定共面 |
| A. | CH4 | B. | C2H5OH | C. | C3H8O | D. | C3H8O2 |