题目内容
7.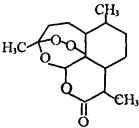 2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年我国科学家屠呦呦因发现青蒿素-一种用于治疗疟疾的药物,对人类的生命健康贡献突出而获得2015年诺贝尔生理学或医学奖.青蒿素结构如图所示.已知一个碳原子上连有4个不同的原子或基团,该碳原子称“手性碳原子”.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素能与碳酸氢钠溶液反应生成二氧化碳 | |
| B. | 青蒿素分子有7个手性碳原子 | |
| C. | 青蒿素在一定条件下能与NaOH溶液反应 | |
| D. | 青蒿素是脂溶性的 |
分析 可根据有机物的结构简式判断分子式为C15H22O5,分子中含有-O-O-键,具有强氧化性,含有-COO-,可发生水解反应,能够与氢氧化钠溶液反应;含有较多憎水基,难溶于水,为脂溶性物质;不含羧基,不能与碳酸氢钠溶液反应,据此进行解答.
解答 解:A.青蒿素分子中不存在羧基,不能与碳酸氢钠溶液反应,故A错误;
B.碳原子连接4个不同的原子或原子团为手性碳原子,如图所示 ,青蒿素分子中含有7个手性碳原子,故B正确;
,青蒿素分子中含有7个手性碳原子,故B正确;
C.分子中含有酯基,可与氢氧化钠反应,故C正确;
D.青蒿素分子中含有酯基,难溶于水,易溶于有机物,属于脂溶性的,故D正确;
故选A.
点评 本题考查有机物的结构和性质,题目难度中等,注意把握有机物官能团的结构和性质,易错点为B,明确手性碳原子的概念为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NOx及CxHy的排放量意义重大(注CxHy为可燃烧的有机物).机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,则下列说法不正确的是( )

| A. | 空/燃比的增大使氧气的浓度增大,因而CO、CxHy的含量会慢慢变小 | |
| B. | 当空/燃比达到15后由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故NOx减少 | |
| C. | 空/燃比的增大,燃烧产生的高温及火花塞放电能促使空气中的氮气与氧气直接生成NO2 | |
| D. | 在机动车尾气出口处使用催化剂能将CO、NOx转化为无害的N2和CO2 |
15.在常温常压下,取下列四种有机物个1mol分别在足量的氧气中燃烧,消耗氧气最多的是( )
| A. | CH4 | B. | C2H5OH | C. | C3H8O | D. | C3H8O2 |
2.1-乙炔基-1-环己醇可用作加成型硅橡胶储存稳定剂、硅氢加成反应抑制剂,还可用作油墨、油漆以及涂料的催干剂等,其结构如图所示: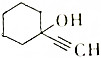 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮( 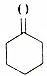 ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(  ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )| A. | 1:1 | B. | 1:2 | C. | 13:49 | D. | 24:49 |
10.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:
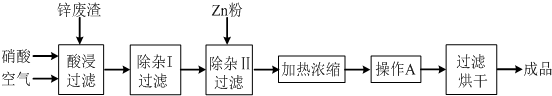
有关氢氧化物开始沉淀和沉淀完全的pH如表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等).(至少写出一个措施)
(2)上述工艺流程中多处涉及“过滤”,过滤时洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.调节pH所用X可以选用AB.
A.ZnO B.ZnCO3 C.H2SO4 D.HNO3
检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却结晶.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,过滤时洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.调节pH所用X可以选用AB.
A.ZnO B.ZnCO3 C.H2SO4 D.HNO3
检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却结晶.
7.NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
| A. | 2 mol N2 | B. | 含NA个分子的Cl2 | ||
| C. | 标准状况下11.2 L的CH4 | D. | 6 g H2 (H2摩尔质量为2 g•mol-1) |
8.下列有关如图所示原电池装置描述正确的是( )
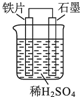

| A. | 石墨电极作负极 | |
| B. | 铁片上的反应:Fe-2e-=Fe2+ | |
| C. | 铁电极附近溶液中氢离子浓度增大 | |
| D. | 电子由石墨电极通过导线流向铁电极 |
 .
.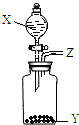 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.