题目内容
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
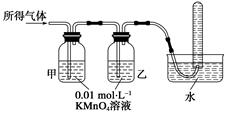
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | | 褪色 | |
| 体现SO2的性质 | 水溶液显酸性 | | |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液 ②蘸有淀粉KI溶液 ③蘸有石蕊溶液 ④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________。
I.(1)分液漏斗(1分)现象 变红(1分) 褪色(1分) 体现SO2的性质 漂白性(1分) 还原性(1分)
(2)SO2+I2+2H2O=SO42-+4H++2I- (2分)
II.(1)2Fe 2++Cl2=2Fe3++2Cl- (2分)
(2)先变红后褪色(1分) (3)氢氧化钠(NaOH)溶液 (1分)
解析试题分析:I.(1)图中仪器p为分液漏斗;SO2溶于水生成H2SO3显酸性,所以石蕊变红;SO2使品红褪色,体现了SO2的漂白性;SO2通入碘水中,SO2被I2氧化,所以碘水褪色,体现了SO2的还原性。
(2)SO2、H2O与I2反应生成HI和H2SO4,HI和H2SO4为强电解质,拆成离子可得离子方程式。
II.(1)Cl2把FeCl2氧化为FeCl3,把FeCl2和FeCl3改写为离子可得离子方程式。
(2)Cl2与H2O反应生成HCl和HClO,显酸性使石蕊变红,HClO具有强氧化性,能漂泊石蕊,所以石蕊先变红后褪色。
(3)Cl2能与强碱溶液反应,所以用NaOH溶液吸收Cl2。
考点:本题考查基本仪器、实验现象的观察与分析、离子方程式的书写、尾气的吸收。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题: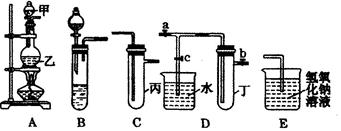
(1)将A、C、E相连后,以浓盐酸和 (填写名称)为原料制取Cl2,仪器乙的名称是 。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅱ获得结论是否合理? (填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由): 。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是 。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先 ,再 以使烧杯中的水进入试管丁,观察现象。
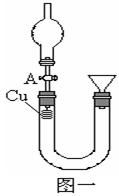
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________;仪器b中可选择的试剂为________;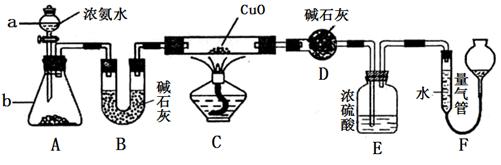
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是( )
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
(4)E装置中浓硫酸的作用_______________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;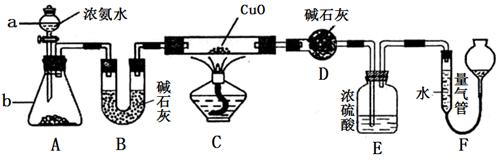
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
|
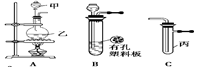
 请按要求填空:
请按要求填空:(1)利用B装置可制取的气体有 (填2种)。
A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为 。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是
。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为 。(保留二位小数)
已知X、Y、Z、W均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物已略)。下列说法不正确的是( )
| A.X、Y、Z中至少有一种相同的元素,该元素可以是金属元素也可以是非金属元素 |
| B.物质W可能是化合物,也可能是单质 |
| C.上述转化关系中不可能出现置换反应 |
| D.若X、Y、Z中均含有一种常见金属元素,则W可能是强酸也可能是强碱 |