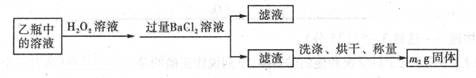
题目内容
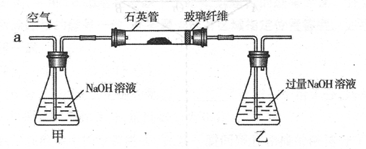
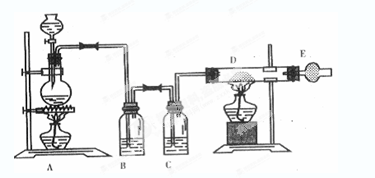
为了证实木炭和浓H2SO4的反应产物,可用下列流程进行验证(箭头表示气体的流向)。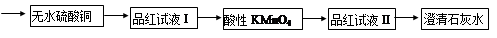
回答下列问题:
根据上述流程中什么现象证明产物是H2O、CO2、SO2:
; ; 。
(2)酸性KMnO4溶液的作用是 ,能否用溴水代替酸性高锰酸钾溶液? 。(填“能”或“不能”),请写出化学反应方程式 (若回答不能,则此空不用答题)
(1)无水硫酸铜变蓝,证明有H2O;品红试液I褪色,证明有SO2;
品红试液Ⅱ不褪色,澄清石灰水变浑浊,证明有CO2
(2)去除SO2;能; Br2+SO2+2H2O=2 HBr+H2SO4
解析试题分析:(1)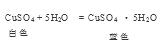 ;SO2可使品红褪色,所以品红试液I褪色,证明有SO2;当品红Ⅱ不褪色时则说明酸性KMnO4已经完全除去SO2气体。所以当石灰水变浑浊时可以说明CO2的存在。
;SO2可使品红褪色,所以品红试液I褪色,证明有SO2;当品红Ⅱ不褪色时则说明酸性KMnO4已经完全除去SO2气体。所以当石灰水变浑浊时可以说明CO2的存在。
(2)SO2具有较强的还原性,可以被强氧化剂KMnO4氧化。因为溴水也具有强氧化性。所以也可以和SO2反应。Br2+SO2+2H2O=2 HBr+H2SO4
考点:考察学生具体掌握SO2的性质,以及CO2和SO2的鉴定问题。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
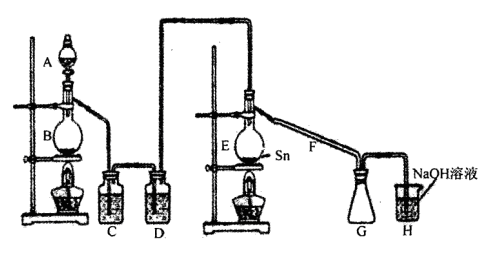
课程达标测试卷闯关100分系列答案用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | | 褪色 | |
| 体现SO2的性质 | 水溶液显酸性 | | |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液 ②蘸有淀粉KI溶液 ③蘸有石蕊溶液 ④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________。
已知:甲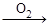 乙
乙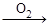 丙
丙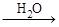 丁,其中丁为强酸,则甲不可能为
丁,其中丁为强酸,则甲不可能为
| A.N2 | B.C | C.S | D.NH3 |


 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O

 = 。
= 。

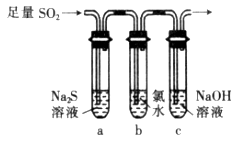
 CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2