题目内容
某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO。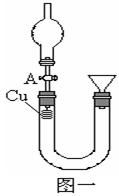
(1)补充完成下列实验步骤:
①__________________________________________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止;
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有_____色气体产生,溶液呈______色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为________________________________。
(3)试管内装有NO,倒置于水槽中,当向试管内通入21mLO2时,最后试管中的液面仍在原来的位置,则原试管中NO的体积为_________mL。
(4)0.1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量_______g。若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入2 mol·L-1的氢氧化钠溶液 _mL。
(1)检查装置气密性(2分)
(2)无 ,蓝 (各1分) 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(3)12mL(2分)
(4)0.96g(2分)40mL(2分)
解析试题分析:向装有NO的试管中通入O2,发生如下反应4NO+3O2+2H2O=4HNO3,假设NO的体积为x则消耗的O2为3x/4,4:3=x:3x/4解得x=12;混合酸中加入足量铜粉发生如下反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,溶液中H+的总量为0.09mol、NO3-的物质的量为0.01,假设Cu的物质的量为x,根据方程式则3:2=x:0.01,解得x=0.015,计算铜的质量为0.96g。且消耗的H+的物质的量为0.04mol,当加入氢氧化钠时先中和掉剩余的H+,需要氢氧化钠的量为0.05mol,将Cu2+全部转化为沉淀,需要氢氧化钠的量为0.03mol,则总共为0.08mol,据体积V=n/C,解得V="0.04L."
考点:结合实验题的元素化合物的相关计算。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)A中制取Cl2的离子方
程式__________________
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2: 向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为____________________________。
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。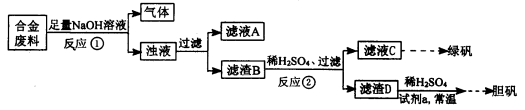
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
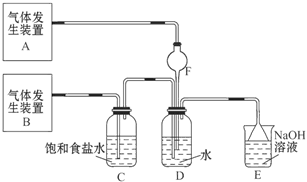
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | | 褪色 | |
| 体现SO2的性质 | 水溶液显酸性 | | |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液 ②蘸有淀粉KI溶液 ③蘸有石蕊溶液 ④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________。

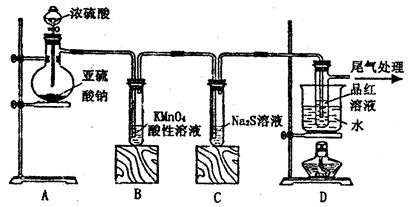
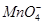 +□H2O=□
+□H2O=□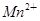 +□
+□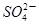 +□H+;
+□H+;
 ,下列说法不正确是
,下列说法不正确是