题目内容
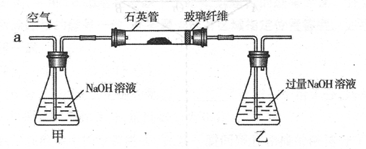
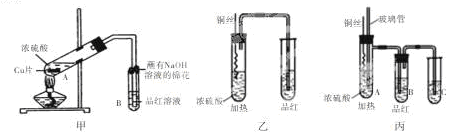
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
|
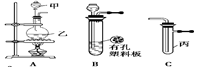
 请按要求填空:
请按要求填空:(1)利用B装置可制取的气体有 (填2种)。
A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。
。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为 。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是
。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为 。(保留二位小数)
(1)H2、CO2、H2S等(1分)
(2)实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白(1分);实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡(1分)
(3)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,(1分)烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,(1分) 证明Cl2的氧化性强于Br2,(1分)
(4)Cu+4HNO3(浓)→Cu(NO3)2+2NO2↑+2H2O (1分)
(5)a 、b (1分); c (1分) 双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁(1分)
(6)42.08(1分)或44.04(1分)
解析试题分析:
(1)B装置适用于块状固体与液体的反应,可制取的气体有H2、CO2、H2S等。
(2)根据题意可知,实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡。
(3)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,Cl2可以氧化得到Br2,证明Cl2的氧化性强于Br2,
(4)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (1分)
(5)结合题中实验目的可知答案。
(6)可设试管体积为10V,①若剩余气体为氧气1V,则反应的9V中二氧化氮的体积为9V×4/5,氧气的体积为9V×1/5,混合气体的平均分子量=46g/mol× + 32g/mol×
+ 32g/mol×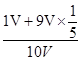 =42.08;②若剩余气体为一氧化氮1V,则原剩余二氧化氮的体积为3V,则反应的7V中二氧化氮的体积为7V×4/5,氧气的体积为7V×1/5,混合气体的平均分子量=46g/mol×
=42.08;②若剩余气体为一氧化氮1V,则原剩余二氧化氮的体积为3V,则反应的7V中二氧化氮的体积为7V×4/5,氧气的体积为7V×1/5,混合气体的平均分子量=46g/mol× + 32g/mol×
+ 32g/mol× =44.04。
=44.04。
考点:考查元素及其化合物、电化学、化学实验、离子浓度判断等相关知识。

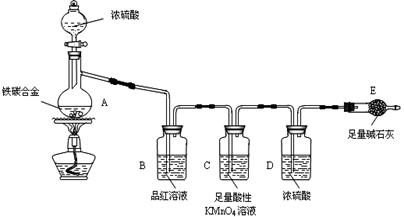
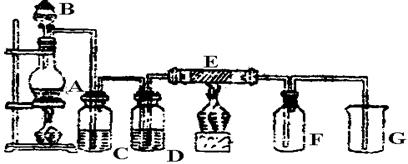
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | | 褪色 | |
| 体现SO2的性质 | 水溶液显酸性 | | |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液 ②蘸有淀粉KI溶液 ③蘸有石蕊溶液 ④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________。
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下: 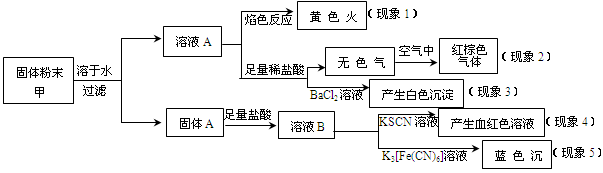
该同学得出的结论正确的是
| A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素 |
| B.根据现象2可推出该固体粉末中一定含有NaNO2 |
| C.根据现象3可推出该固体粉末中一定含有Na2SO4 |
| D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |

 CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2