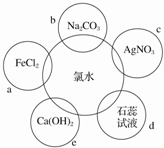
题目内容
5.某城市某日的空气质量报告中污染指数如下表:| 污 染 指 数 | ||
| SO2 | NO2 | PM10 |
| 49 | 21 | 23 |
(1)当日首要污染物是SO2;空气质量状况为轻度污染(填写“优”、“良”、“轻微污染”、“中度污染”);
(2)其中PM10所指的是可吸入颗粒物 (填写污染物对应的名称)
(3)氮氧化物的人为来源主要是化石燃料的燃烧,在城市中大气中的氮氧化物主要来自汽车尾气;
(4)SO2、NO2、PM10这三种物质能够形成酸雨的是SO2、NO2.
分析 (1)
| 一级 | 二级 | 三级 | 四级 | 五级 | 六级 | |
| AQI | 1~50 | 51~100 | 101~150 | 151~200 | 201~300 | >300 |
| 空气质量 | 优 | 良 | 轻度污染 | 中度污染 | 重度污染 | 严重污染 |
(2)PM10是对空气中直径小于或等于10微米的固体颗粒或液滴的总称;
(3)氮氧化物的人为来源主要是化石燃料的燃烧,在城市中大气中的氮氧化物主要来自汽车尾气;
(4)二氧化硫和二氧化氮溶于雨水,会形成酸雨.
解答 解:(1)当日首要污染物是SO2;49+21+23=103,为轻度污染,故答案为:SO2;轻度污染;
(2)PM10是对空气中直径小于或等于10微米的固体颗粒或液滴的总称,故答案为:可吸入颗粒物;
(3)氮氧化物的人为来源主要是化石燃料的燃烧,汽车尾气则是城市大气中氮氧化物的主要来源之一,故答案为:化石燃料;汽车尾气;
(4)二氧化硫和二氧化氮溶于雨水,会形成酸雨,其化学式分别是SO2和NO2,故答案为:SO2、NO2.
点评 本题考查环境污染及治理,为高频考点,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
11.氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=$\frac{3△H{\;}_{1}+2△H{\;}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键吸收的总能量小于形成2mol NH3(g)中的化学键放出的总能量.①则T1<T2(填“>”、“<”或“=”)
②在T2时,经过10min达到化学平衡状态,则0至10min内H2的平均反应速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.

(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H=$\frac{3△H{\;}_{1}+2△H{\;}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
②在T2时,经过10min达到化学平衡状态,则0至10min内H2的平均反应速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.

13.HA与醋酸酸性相似,下列叙述错误的是( )
| A. | HA水溶液中微粒浓度大小顺序:c(HA)>c(H+)>c(A-)>c(OH-) | |
| B. | NaA水溶液中:c(Na+)═c(A-)+c(HA) | |
| C. | HA与NH3作用生成的化合物是共价化合物 | |
| D. | 稀释0.1mol/LHA水溶液,其电离程度增大,pH也增大 |
10. 在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)该反应在60S内用NO2的表示的反应速率为0.002 mol•L-1•s-1.
(2)下表是不同温度下测定得到的该反应的化学平衡常数.
据此可推测该反应(生成NO2)是吸热反应(填“吸热”或“放热”). 升高温度,平衡向正反应方向移动(填“正反应”或“逆反应”).
 在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)(1)该反应在60S内用NO2的表示的反应速率为0.002 mol•L-1•s-1.
(2)下表是不同温度下测定得到的该反应的化学平衡常数.
| T/K | 323 | 373 |
| K值 | 0.022 | ? |
17.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 0.1mol的CaC2中含阴离子数是0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO${\;}_{3}^{-}$和CO${\;}_{3}^{2-}$离子数之和为0.1NA |
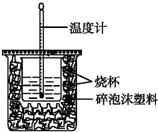 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: