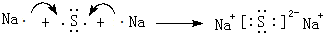题目内容
18.请回答:(1)用氧化物表示翡翠:NaAl(SiO3)2的组成Na2O•Al2O3•6SiO2.
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)在NaHSO4溶液中滴加Ba(OH)2溶液恰好完全沉淀,写出反应的离子方程式Ba2++OH-+H++SO42-═H2O+BaSO4↓
(4)写出化学反应方程式用氨气制硝酸的第一步4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)用氧化物表示物质的组成时,要按照:活泼金属氧化物•不活泼金属氧化物•SiO2•H2O的顺序来书写;
(2)镁能在二氧化碳中燃烧生成黑色的碳和白色的氧化镁;
(3)向NaHSO4溶液滴入Ba(OH)2溶液直至溶液中的SO42-沉淀完全,反应生成硫酸钡、氢氧化钠和水;
(4)用氨气制硝酸的第一步是氨气的催化氧化.
解答 解:(1)用氧化物表示物质的组成时,要按照:活泼金属氧化物•不活泼金属氧化物•SiO2•H2O的顺序,故NaAl(SiO3)2的组成可以表示为:Na2O•Al2O3•6SiO2,
故答案为:Na2O•Al2O3•6SiO2;
(2)镁能在二氧化碳中燃烧,化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)向NaHSO4溶液滴入Ba(OH)2溶液直至溶液中的SO42-沉淀完全,反应生成硫酸钡、氢氧化钠和水,离子方程式:Ba2++OH-+H++SO42-═H2O+BaSO4↓;
故答案为:Ba2++OH-+H++SO42-═H2O+BaSO4↓;
(4)用氨气制硝酸的第一步是氨气的催化氧化,方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了常见的化学方程式的书写和矿物质改写为氧化物的方法,题目难度不大,注意根据条件来书写离子方程式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列有关晶体的叙述中,不正确的是( )
| A. | 金刚石的网状结构中,由共价键形成的碳原子环,其中最小的环上有6个碳原子 | |
| B. | 在氯化钠晶体中,每个Na+或Cl-的周围紧邻6个Cl-或6个Na+ | |
| C. | 干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键 | |
| D. | 在氯化铯晶体中,每个Cs+周围紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+ |
9.下列说法正确的是( )
| A. | 化学反应是放热还是吸热与反应条件有关 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 反应是吸热还是放热必须看反应物和生成物所具有的总能量的大小 |
6.下列实验能获得成功的是( )
| A. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量己烯 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 可用分液漏斗分离二溴乙烷和二甲苯 |
13.下列说法错误的是( )
| A. | 钠的金属性比镁强 | B. | 溴的非金属性比氯强 | ||
| C. | 硝酸的酸性比磷酸弱 | D. | 水的稳定性比氨强 |
3.下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤

| A. | ①③④ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②⑤ |
8.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列结论正确的是( )
| A. | PbO2为正极被氧化 | B. | 溶液的pH不断减小 | ||
| C. | SO42-只向PbO2处移动 | D. | 消耗1mol H2SO4时转移2mol电子 |
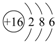 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程