题目内容
11.某市售硫酸试剂瓶标签上的部分信息如下:
(1)该硫酸的物质的量浓度为18.4mol•L-1.
(2)①用该浓度的硫酸配置500mL0.1mol•L-1硫酸时,需该浓度的硫酸的体积为2.7mL,用到的实验仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
②定容时,加水超过刻度线后,吸出多余部分会使所配硫酸浓度偏小.
(3)取稀释后的适量硫酸与足量的锌粒反应,生成标准状况下11.2LH2,则反应中转移的电子数为6.02×1023.
分析 (1)根据c=$\frac{1000ρω}{M}$计算;
(2)①根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸体积;配制500mL稀硫酸所用的实验仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
②定容时,加水超过刻度线后,所配溶液浓度偏小;
(3)根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据H元素化合价变化计算转移电子数目.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,密度为1.84g/mL、质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4;
(2)①根据稀释定律,稀释前后溶质硫酸的物质的量不变,需要浓硫酸体积为$\frac{500mL×0.1mol/L}{18.4mol/L}$=2.7mL;
配制500mL稀硫酸所用的实验仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:2.7;胶头滴管;
②定容时,加水超过刻度线后,所配溶液浓度偏小,溶液是均一,吸出多余部分后剩余溶液浓度与所配溶液浓度相等,
故答案为:偏小;
(3)氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,
故答案为:6.02×1023.
点评 本题考查物质的量浓度计算、一定物质的量浓度溶液配制、氧化还原反应计算,注意掌握物质的量浓度与质量分数之间关系.

练习册系列答案
相关题目
1.用适当的方法使NaCl分散于苯中形成无色透明液体,当一束强光通过该液体可以观察到丁达尔现象,这表明该液体属于( )
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
19.下列反应在常温下均能自发进行,其中不符合焓判据的是( )
| A. | 2NO(g)+O2(g)═2NO2(g) | |
| B. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq) | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g) | |
| D. | 2NO2(g)═N2O4(g) |
6.下列离子组能在溶液中大量共存的是( )
| A. | Mg2+、Fe3+、SO42-、I- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Na+、Fe3+、HCO3-、Cl- | D. | Mg2+、Fe3+、SO42-、Cl- |
3.下列各组物质混合后,没有明显现象的是:①H2S和S02;②S02和SO3③SO2和氯水;④S03(气)和C12;⑤H2S和C12( )
| A. | ①③⑤ | B. | ②④ | C. | ②⑤ | D. | ③④⑤ |
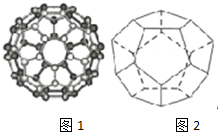 碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖
碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖