题目内容
2. 碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖
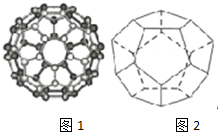
碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖(1)C60分子是形如足球状的多面体(如图)由12个五边形和20个六边形组成,分子中每个碳原子只跟相邻的3个的3个碳原子形成化学键.
①C60中C原子的轨道杂化方式是sp2,每个C原子跟相邻的3个碳原子形成3个σ键、1个π键;
②固体C60与金刚石相比较,熔点较高者应是金刚石,理由是C60属于分子晶体而金刚石属于原子晶体
③科学界拟合成一种“二重构造”的球形分子(C60Si60),即把“足球型”的C60置于“足球型”的Si60内并
把硅原子与原子与碳原子以共价键结合,合成“二重构造”球形分子C60Si60的化学反应类似于D(填序号)
A.由乙烷制氯乙烷
B.由乙酸与乙醇制乙酸乙酯
C.有乙醇制取乙醛
D.由乙烯与丙烯合成乙丙树脂
(2)德国和美国科学家首先制出20个碳原子组成的空心笼状分子C60,该笼状结构是由许多正五边形构成(如图2),C60分子共有12个正五边形,共有30条棱边.
(3)2010年,我国科研人员成功合成了碳的又一种碳的同素异形体--石墨块、石墨块是由1,3-二炔键(C=C-C≡C-)将苯环连接形成的二维平面网状结构的全碳分子,有关石墨块的叙述错误的是ABCD
A.所有原子都在一条直线上
B.属于芳香烃
C.属于原子晶体
D.能与氢气反应得到石墨.
分析 (1)①分子中每个碳原子只跟相邻的3个碳原子形成化学键,根据C的四价原理可知,每个碳原子形成2个单键和1个双键,其价层电子对数为3;
②原子晶体的熔点很高,分子晶体的熔点较低;
③C60置于“足球型”的Si60内合成“二重构造”球形分子C60Si60,该反应中反应物全部加合在一起,类似有机反应中的加成反应;
(2)根据图片知,每个顶点上有1个碳原子,所以顶点个数等于碳原子个数为20,每个顶点含有棱边数=$\frac{1}{2}$×3=1.5,每个面含有顶点个数=$\frac{1}{3}$×5=$\frac{5}{3}$,利用均摊法计算;
(3)A.分子中含有环状结构;
B.分子中不含有H原子,不是烃;
C.由分子构成,属于分子晶体;
D.与石墨的组成元素相同.
解答 解:(1)①分子中每个碳原子只跟相邻的3个碳原子形成化学键,根据C的四价原理可知,每个碳原子形成2个单键和1个双键,其价层电子对数为3,则轨道杂化方式是sp2,2个单键中含有2个σ键,一个双键中含有1σ键和1个π键,所以每个C原子跟相邻的3个碳原子形成3个σ键、1个π键;
故答案为:sp2;3;1;
②原子晶体的熔点很高,分子晶体的熔点较低,C60属于分子晶体而金刚石属于原子晶体,所以金刚石的熔点高;
故答案为:金刚石;C60属于分子晶体而金刚石属于原子晶体;
③C60置于“足球型”的Si60内合成“二重构造”球形分子C60Si60,该反应中反应物全部加合在一起,类似有机反应中的加成反应,所以与由乙烯与丙烯合成乙丙树脂的反应类似;
故答案为:D;
(2)根据图片知,每个顶点上有1个碳原子,所以顶点个数等于碳原子个数为20,每个顶点含有棱边数=$\frac{1}{2}$×3=1.5,则棱边数=1.5×20=30,每个面含有顶点个数=$\frac{1}{3}$×5=$\frac{5}{3}$,则面数=$\frac{20}{\frac{5}{3}}$=12,
故答案为:12;30;
(3)A.石墨块是由1,3-二炔键(C=C-C≡C-)将苯环连接形成的二维平面网状结构的全碳分子,分子中含有环状结构,则所有原子不能都在一条直线上,故A错误;
B.分子中不含有H原子,不是烃,烃是含有碳氢两种元素的有机物,故B错误;
C.由分子构成,属于分子晶体,不是原子晶体,故C错误;
D.与石墨的组成元素相同,与石墨互为同素异形体,所以不能氢气反应得到石墨,故D错误.
故答案为:ABCD.
点评 本题考查了共价键的类型、杂化方式的确定、晶体的性质、晶胞的计算等知识点,题目难度中等,晶胞的计算、杂化方式的判断等都是常考查的知识点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 原电池负极发生氧化反应 | |
| B. | 原电池工作时溶液中的阳离子向正极移动 | |
| C. | 原电池工作时电子由负极沿导线流向正极,再经电解质溶液流回负极 | |
| D. | 原电池反应一定属于氧化还原反应 |
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
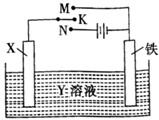
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
| A. | H2O2+Ba(OH)2═BaO2+2H2O | |
| B. | Ag2O+H2O2═2Ag+O2↑+H2O | |
| C. | 2H2O2═2H2O+O2↑ | |
| D. | 3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O |
 X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层电子数的3倍,下列说法中不正确的是( )
| A. | 气态氢化物的稳定性:Y>Z | |
| B. | 最高价氧化物物对应水化物酸性:Z>W | |
| C. | X的气态氢化物与Y、Z、W的气态氢化物都可以反应 | |
| D. | 气态氢化物的沸点,Y最高 |
| A. | NaOH | B. | CH4 | C. | H2SO4 | D. | KNO3 |
| 温度 物质的量 时间 | 2min | 4min | 6min | 8min | 10min | 12min |
| 450℃ | 0.2mol | 0.3mol | 0.35mol | 0.40mol | 0.50mol | 0.50mol |
| 480℃ | 0.25mol | 0.35mol | 0.45mol | 0.60mol | 0.60mol | 0.60mol |
| A. | 该反应是熵增,焓增的反应,在较高温度下能自发进行 | |
| B. | 恒温恒压,达到新平衡时,c(CO2)不变,c(MgCO3)增大 | |
| C. | 在2~8min之间CO2平均速率v(CO2)=$\frac{1}{30}$mol•L-1•min-1 | |
| D. | 升高温度,该反应平衡常数、分解速率和MgCO3分解率都增大. |
| 容器编号 | 起始时各物质物质的量(mol) | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 46.3kJ |
| ② | 0.6 | 1.8 | 0.8 | Q (Q>0) |
(2)列式计算①中反应的平衡常数$\frac{4}{27}$(计算结果用分数表示))
(3)容器②中反应达到平衡时放出(填“吸收”或“放出”)的热量为Q=9.26kJ
(4)若容器①体积为0.40L,则达平衡时放出的热量大于(填“大于”“等于”“小于”)46.3kJ.
