题目内容
15.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:(已知:在25℃,100kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol)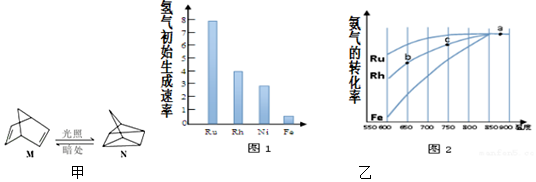
(1)有机物M经过太阳光光照可转化成N,转化过程如图甲:
△H=+88.6kJ/mol则M、N的稳定性相比,M>N.使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1.
(2)氨气易液化,便于储运,可利用NH3作储氢材料.
已知:2NH3(g)?N2(g)+3H2(g)△H=+92.4kJ•mol-1
一定温度下,在2L的密闭容器中投入2mol的NH3,当达到平衡时放出的热量为60.1kJ,则此时NH3的转化率为65%.
其他条件相同,该反应在不同催化剂作用下,氢气初始生成速率如图1,相同时间氨气的转化率随反应温度的变化如图2.
则反应的活化能最大的是Ru(填催化剂的化学式).c点氨气的转化率高于b点,原因是点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高.
请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线.
分析 (1)M转化为N是吸热反应,所以N的能量高,能量越高越不稳定;根据反应热与化学计量数成正比关系以及注明物质的聚集状态与反应热书写热化学方程式;
(2)根据放出的热量计算参加反应氮气物质的量,进而计算氨气转化率;
氢气初始生成速率越大,说明催化剂催化性能越高;
点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高;
催化剂不影响平衡移动,平衡时转化率不变,Ni的催化性能比Fe高,但比Rh低,相同温度下氨气转化率高于催化剂Fe的、小于催化剂Rh的.
解答 解:(1)M转化为N是吸热反应,所以N的能量高,能量越高越不稳定,能量越低越稳定,故稳定性M>N,有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
故答案为:>;2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
(2)参加反应氨气物质的量为2mol×$\frac{60.1kJ}{92.4kJ}$=1.3mol,故氨气转化率为$\frac{1.3mol}{2mol}$×100%=65%;
氢气初始生成速率越大,说明催化剂催化性能越高,由图可知Ru的催化性能最好;
点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高;
催化剂不影响平衡移动,平衡时转化率不变,Ni的催化性能比Fe高,但比Rh低,相同温度下氨气转化率高于催化剂Fe的、小于催化剂Rh的,Ni催化分解氨气过程的总趋势曲线如图: ,
,
故答案为:65%;Ru;点b、c均未达到平衡,相同时间,C点温度较高,反应速率较快,故C点的氨气的转化率较高; .
.
点评 本题考查化学反应中能量变化、热化学方程式书写、化学平衡计算、化学平衡图象等,侧重考查分析解决问题能力,难度中等.

| A. | 标准状况下,NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl溶液反应,转移的电子数为3NA | |
| C. | 2 L 1 mol•L-1的H3PO4溶液中所含的H+数为6NA | |
| D. | 标准状况下22.4 L Cl2通入足量的石灰乳制备漂白粉,转移电子数为NA |
| A. | 钠投入水中立即熔化成闪亮的小球,说明反应放热且钠的熔点低 | |
| B. | 钠在空气中燃烧生成淡黄色的Na2O2 | |
| C. | 金属钠可以将铜从其盐溶液中置换出来 | |
| D. | 实验后剩余的钠块能放回原试剂瓶中 |
| A. | 17gNH3所含中子数目为10 NA | |
| B. | 常温常压下,22 g氧气和26 g臭氧所含的氧原子总数为3NA | |
| C. | 常温常压下,18g H2O含有的电子总数为8NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| A. | 氧化 | B. | 还原 | C. | 催化 | D. | 提供能量 |
| A. | NH3 | B. | (NH4)2SO4 | C. | Cl2 | D. | CH3CH2OH(乙醇) |
| A. | 食盐 | B. | 味精 | C. | 小苏打 | D. | 食醋 |