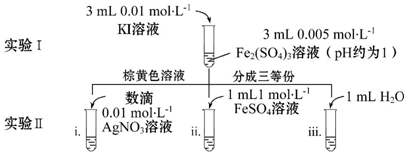
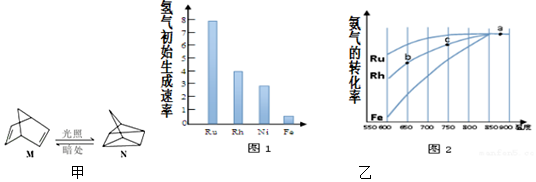
题目内容
7.下列物质属于电解质的是( )| A. | NH3 | B. | (NH4)2SO4 | C. | Cl2 | D. | CH3CH2OH(乙醇) |
分析 在水溶液中或熔融状态下能导电的化合物为电解质,包括酸、碱、盐、金属氧化物和水等,据此分析.
解答 解:A、氨气溶于水后是生成的一水合氨能电离出自由移动离子而导电,和氨气无关,故氨气为非电解质,故A错误;
B、硫酸铵在水溶液中和熔融状态下均能导电,故为电解质,故B正确;
C、氯气是单质,既不是电解质也不是非电解质,故C错误;
D、乙醇在水溶液中和熔融状态下均不能导电,故为非电解质,故D错误.
故选B.
点评 本题考查了电解质、非电解质的判断,把握概念的要点是解题关键,应注意的是电解质和非电解质必须都是化合物.

练习册系列答案
相关题目
7.近日由美国斯坦福大学研究团队利用微加工技术在二氧化硅薄片上蚀刻微米量级的小孔,设计出一种能为太阳能电池板降温的二氧化硅光子晶体涂层材料.下列关于该材料的说法正确的是( )
| A. | 该材料耐高温、易导热、耐酸碱性强 | |
| B. | 该材料的主要成分也可用于制作太阳能电池板 | |
| C. | 网络通讯所用的光导纤维与该材料具有相同的化学成分 | |
| D. | 该光子晶体是平面网状结构,每隔Si与2个O成键,每个O与2个Si成键 |
2.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2?2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是( )
| A. | 2molSO2+1molO2 | B. | 2molSO2+1molO2+2molSO3 | ||
| C. | 4molSO2+1molO2 | D. | 3molSO2+0.5molO2+1molSO3 |
19.下列物质的导电性能最差的是( )
| A. | 熔化的氢氧化钠 | B. | 0.1 mol/L盐酸 | C. | 0.1 mol/L醋酸 | D. | 氯化钾固体 |
17.136C-NMB(核磁共振)可用于含碳化合物的结构分析,下列关于136C说法正确的是( )
| A. | 核外有13个电子,核内有13个质子 | |
| B. | 质量数为13,原子序数为6,核内有7个质子 | |
| C. | 136C与126C互为同位素 | |
| D. | 质量数为13,质子数为6,中子数为6 |