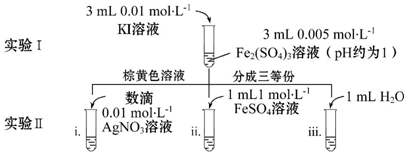
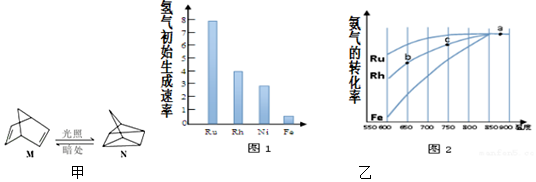
题目内容
14.0.3molNH3分子中所含氢原子数与0.45NA个H2O分子中所含氢原子数相等.分析 根据氨气分子中含有H原子数目计算H原子物质的量,进而计算水分子物质的量,再根据N=nNA计算水分子数目.
解答 解:与0.3mol NH3分子中所含氢原子数相等的水的物质的量为:$\frac{0.3mol×3}{2}$=0.45mol,
故需要水分子数目为:0.45mol×NAmol-1=0.45NA,
故答案为:0.45NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
5.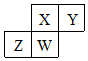 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
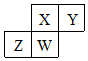 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Y、Z、W的最高化合价分别与其主族序数相等 | |
| C. | 最简单气态氢化物的热稳定性:X>Z>W | |
| D. | 最高价氧化物对应水化物的酸性:X>Z>W |
2.气态烃1体积可与2体积氯化氢发生加成,生成氯代烷烃,此氯代烷烃1mol可与6mol氯气发生完全的取代反应,则该烃的结构简式为( )
| A. | CH2=CH2 | B. | CH2=CHCH=CH2 | C. | CH4 | D. | CH≡C-CH3 |
19.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | FeCl2溶液:K+、Na+、SO42-、AlO2- | |
| B. | 使紫色石蕊试液变红的溶液:Na+、Fe2+、NO3-、SO42- | |
| C. | 向存在大量Na+、Cl-的溶液中通入足量的NH3后:NH4+、Fe3+、SO42- | |
| D. | 在强酸性溶液中:K+、Fe2+、SO42-、Br- |
3.下列关于仪器使用的说法正确的是( )
| A. | 滴定管装滴定液时不应先用滴定液润洗 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 振荡分液漏斗时应关闭其玻璃塞和活塞 |
 其中:a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物.
其中:a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物.