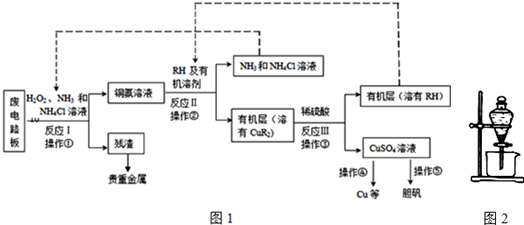
题目内容
14.在标准状况下,将质量为相同状况下等体积H2质量16倍的CO和CO2的混合气体,充满盛有足量Na2O2且容积为22.4L的密闭容器内(设固体物质的体积忽略不计),用间断发生的电火花引发反应,使可能发生的反应充分进行.计算:(1)反应前CO和CO2的物质的量各为多少?
(2)最后容器里有几种生成物?质量各是多少?
分析 质量为相同状况下等体积H2质量16,混合气体的平均摩尔质量为:M=32g/mol,设混合气体中CO为xmol,CO2为ymol,根据M=$\frac{28x+44y}{x+y}$=32计算二者的物质的量之比,进而计算物质的量;
由2CO+O2=2CO2,以及2CO2+2Na2O2=2Na2CO3+O2,二者相加可得CO+Na2O2=Na2CO3,反应后容器中存在的生成物为O2和Na2CO3,根据反应的化学方程式计算.
解答 解:(1)质量为相同状况下等体积H2质量16,混合气体的平均摩尔质量为:M=32g/mol,设混合气体中CO为xmol,CO2为ymol,由M=$\frac{28x+44y}{x+y}$=32可知x:y=3:1,
气体的物质的量共为$\frac{22.4L}{22.4L/mol}$=1moL,
所以n(CO)=0.75mol,n(CO2)=0.25mol,
答:反应前CO和CO2的物质的量各为0.75mol、0.25mol;
(2)由2CO+O2=2CO2,以及2CO2+2Na2O2=2Na2CO3+O2,二者相加可得CO+Na2O2=Na2CO3,由方程式关系可知:
CO+Na2O2=Na2CO3
0.75mol 0.75mol
2CO2+2Na2O2=2Na2CO3+O2
0.25mol 0.25mol 0.125mol
所以n(Na2CO3)=0.75mol+0.25mol=1mol,n(O2)=0.125mol,
则m(Na2CO3)=1mol×106g/mol=106g,m(O2)=0.125mol×32g/mol=4g,
答:最后容器里有2种生成物,质量各是m(Na2CO3)=106g,m(O2)=4g.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,本题注意利用CO+Na2O2=Na2CO3,为解答该题的关键,难度中等.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案| A. | NaOH、BaCl2、Na2CO3、HCl | B. | BaCl2、HCl、Na2CO3、NaOH | ||
| C. | BaCl2、Na2CO3、HCl、NaOH | D. | Na2CO3、NaOH、BaCl2、HCl |
| A. | 0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 | |
| B. | 1mol CO+1mol H2O(g)+1mol CO2+1mol H2 | |
| C. | 0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 | |
| D. | 0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
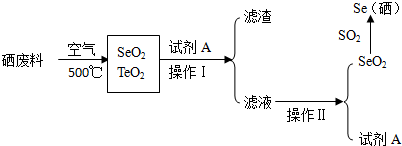
已知如下信息:
Ⅰ.硒废料中含硒约97%,其余为碲和微量的氯.
Ⅱ.灼烧过程中,硒、碲分别转化成SeO2、TeO2.
Ⅲ.SeO2、TeO2的部分物理性质如下:
 | 沸点/℃ | 溶解性 |
| SeO2 | 684 | 易溶于水和乙醇 |
| TeO2 | 1260 | 微溶于水,不溶于乙醇 |
(1)硒和溴位于同周期,下列性质不能说明溴的非金属性比硒强的是A.(填代号)
A.沸点:Se>Br2 B.还原性:H2Se>HBr
C.酸性:H2SeO4<HBr O4 D.还原性:Se>Br2
(2)在周期表中硒和硫位于同主族且相邻,则硒和硫的原子序数相差18;硒在周期表中的位置是第四周期ⅥA族.
(3)在硒废料灼烧过程中,为了提高反应速率,宜采用的措施有粉碎废料、搅拌(写一条即可).
(4)上述流程中,可循环利用的物质是乙醇(CH3CH2OH);操作II的名称是蒸馏.
(5)写出SeO2和SO2反应的化学方程式并注明电子转移数目和方向:
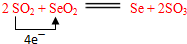 .
. | A. | K层多 | B. | L层多 | C. | 相等 | D. | 不能确定 |
| A. | 原子半径:Li<Na<K | B. | 稳定性:PH3>H2S>HCl | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |
| A. | BaCl2、HCl | B. | Ba(NO3)2、HNO3 | C. | Ba(NO3)2、HCl | D. | BaCl2、H2SO4 |
| A. | NaF | B. | K2O | C. | NaCl | D. | MgBr2 |