题目内容
相同温度相同物质的量浓度的六种溶液:①NaHCO3 ②CH3COONa ③NaOH④Ba(OH)2 ⑤NaHSO4 ⑥H3PO4 按pH值由大到小的顺序是( )
| A、⑥⑤②①④③ |
| B、⑥⑤①②③④ |
| C、④③②①⑤⑥ |
| D、④③①②⑥⑤ |
考点:盐类水解的应用
专题:盐类的水解专题
分析:根据溶液的酸碱性以及利用盐类的水解程度比较浓度相同的溶液的pH大小.
解答:
解:同温度相同物质的量浓度下列溶液中,
⑤NaHSO4为强酸的酸式盐,水溶液呈酸性;
⑥H3PO4为中强酸,水溶液呈酸性,但氢离子浓度小于硫酸氢钠溶液中的氢离子浓度,所以磷酸溶液的pH值大于硫酸氢钠溶液的pH值,⑥>⑤;
①NaHCO3、②CH3COONa都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,pH越大,①②④对应酸根离子的水解程度大小为CH3COO-<HCO3-<CO32-,③NaOH溶液,④Ba(OH)2是强碱,PH大小④>③,所以pH由大到小的顺序④③①②⑥⑤,
故选D.
⑤NaHSO4为强酸的酸式盐,水溶液呈酸性;
⑥H3PO4为中强酸,水溶液呈酸性,但氢离子浓度小于硫酸氢钠溶液中的氢离子浓度,所以磷酸溶液的pH值大于硫酸氢钠溶液的pH值,⑥>⑤;
①NaHCO3、②CH3COONa都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,pH越大,①②④对应酸根离子的水解程度大小为CH3COO-<HCO3-<CO32-,③NaOH溶液,④Ba(OH)2是强碱,PH大小④>③,所以pH由大到小的顺序④③①②⑥⑤,
故选D.
点评:本题考查了溶液PH的大小比较方法应用,主要是离子水解的应用,酸越弱,阴离子水解程度越大.

练习册系列答案
相关题目
相同物质的量浓度的下列化合物的水溶液,按pH由大到小的顺序排列是( )
| A、NaHSO4 CH3COONa NH4Cl NaNO3 |
| B、NaNO3 CH3COONa NaHSO4 NH4Cl |
| C、CH3COONa NaNO3 NH4Cl NaHSO4 |
| D、NaNO3CH3COONa NH4Cl NaHSO4 |
有两个带活塞的密闭容器A和B,A中装有N2,B中装有NO2,它们的温度、压强、体积均相同,然后慢慢压缩活塞,当两个容器内的压强都是原来5倍时(恒温),则两个容器的体积关系是( )
| A、相等 | B、A>B |
| C、B>A | D、无法判断 |
下列说法中正确的是( )
| A、溶液与胶体:本质不同的原因是能否发生丁达尔效应 |
| B、用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90g |
| C、从1L 1mol?L-1的NaCl溶液中取出10 mL,其浓度仍是1mol?L-1 |
| D、10g 98%硫酸(密度为1.84 g/cm3)与10mL 18.4mol?L-1硫酸的浓度是不同的 |
下列说法中正确的是( )
| A、水溶液中,1mol KCl和1mol NaCl电离出的氯离子一样多 |
| B、电解质Ba(OH)2的电离方程式为:Ba(OH)2=Ba2++OH- |
| C、凡溶于水后能电离出H+的物质都是酸 |
| D、BaSO4的水溶液不导电,BaSO4属非电解质 |
下列反应不能用于比较金属性或非金属性强弱的是( )
| A、非金属性Cl2>Br2:Cl2+2NaBr═2NaCl+Br2 |
| B、非金属性C>Si:Na2SiO3+CO2+H2O═Na2CO3+H2SiO3↓ |
| C、非金属性S>C:Na2CO3+2SO2+H2O═2NaHSO3+CO2 |
| D、金属性Mg>Al:MgCl2+2NaOH═Mg(OH)2↓+2NaCl AlCl3+4NaOH═NaAlO2+3NaCl+2H2O |
已知:N2(g)+3H2(g)?2NH3(l)△H=-132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是( )
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
A、如图可表示合成氨过程中的能量变化 |
| B、a的数值为1173 |
| C、Q的数值为92 |
| D、其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量 |
下列叙述中正确的是( )
| A、NaOH的摩尔质量为40g |
| B、64g SO2中含有1mol O2 |
| C、1mol N2的体积为22.4L |
| D、0.5mol CO2约含有3.01×1023个CO2分子 |
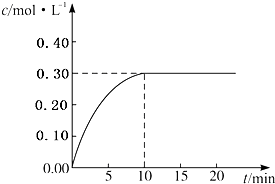 目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:
目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示: