题目内容
20.现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取20.00mL该酸溶液,逐滴加入0.2mol/L的氢氧化钠溶液,恰好反应完全时所需碱液体积为20.00mL,请用化学用语回答:(1)该酸不可能是硫酸;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为醋酸,用离子方程式说明溶液呈碱性的原因CH3COO-+H2O?CH3COOH+OH-.
分析 (1)某酸的物质的量为0.2mol/L×0.02L=0.004mol,氢氧化钠的物质的量0.02L×0.2mol/L=0.004mol,酸和碱的物质的量之比1:1,所以酸为一元酸;
(2)用pH试纸测得反应后所得溶液呈碱性,为强酸弱碱盐,应为醋酸与氢氧化钠的反应.
解答 解:(1)某酸溶液物质的量为0.2mol/L×12.50mL,氢氧化钠溶液的物质的量25.00mL×0.1mol/L,酸和碱的物质的量之比1:1,所以酸为一元酸,不可能为硫酸,
故答案为:硫酸;
(2)醋酸与氢氧化钠反应生成醋酸钠,醋酸根离子水解:CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:醋酸;CH3COO-+H2O?CH3COOH+OH-.
点评 本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力考查,注意把握弱电解质的电离特点,难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
10.酸雨能造成多方面的危害,下列说法中与酸雨有直接关系的是( )
①造成植物死亡 ②造成土壤酸化 ③使湖泊富营养化,鱼类死亡 ④危害建筑设施 ⑤危害桥梁和电缆.
①造成植物死亡 ②造成土壤酸化 ③使湖泊富营养化,鱼类死亡 ④危害建筑设施 ⑤危害桥梁和电缆.
| A. | ②③ | B. | ③④⑤ | C. | ①③⑤ | D. | ①②④⑤ |
11.能正确表示下列反应的离子方程式是( )
| A. | 将磁性氧化铁溶于稀硫酸:Fe3O4+8H+=3Fe3++4H2O | |
| B. | 0.2mol明矾与300mL1mol/L的氢氧化钡溶液混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
8.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入H2O(g)使体系压强增大 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入N2使体系压强增大 | |
| D. | 保持压强不变,充入N2使容器体积变大 |
15.下列物质可用分液漏斗分离的是( )
| A. | 碘与酒精 | B. | 硝基苯与水 | C. | 苯与溴苯 | D. | 乙酸与水 |
9.战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | Na2Ca | C. | Si02 | D. | CaC03 |
10.2A(g)?2B(g)+C(g)△H>0,达平衡时,要使v正降低、c(A)增大,应采取( )
| A. | 加压 | B. | 减压 | C. | 减小B的浓度 | D. | 降温 |
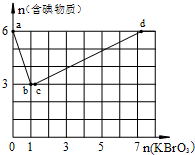 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.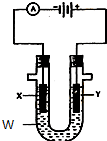 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: