题目内容
8.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )| A. | 保持体积不变,充入H2O(g)使体系压强增大 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入N2使体系压强增大 | |
| D. | 保持压强不变,充入N2使容器体积变大 |
分析 反应中有固体参加,改变固体的量对反应速率没有影响,如气体的浓度不变,则反应速率不变,而浓度、压强、温度以及催化剂影响反应速率,以此解答该题.
解答 解:A.保持体积不变,充入H2O(g)使体系压强增大,水的浓度增大,反应速率增大,故A不选;
B.将容器的体积缩小一半,增大体系压强,气体浓度增大,反应速率增大,故B不选;
C.保持容器容积不变,充入氮气使体系压强增大,但参加反应的气体的浓度不变,则反应速率不变,故C选;
D.保持压强不变,充入氮气使容器容积增大,参加反应的气体的分压减小,反应速率减小,故D不选.
故选C.
点评 本题考查反应速率的影响因素,为考试高频考点,难度不大,注意把握固体的特点,易错点为D,注意氮气对浓度、压强的影响.

练习册系列答案
相关题目
18.(1)酸雨是指pH小于5.6的降水,这是由于人为排放的二氧化硫和氮氧化物等酸性气体转化而成的.
(2)某校科技小组的同学们采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
根据上述材料回答下列问题:酸雨放置一段时间后,pH发生变化的主要原因为(用一个化学方程式表示):2H2SO3+O2=2H2SO4.
(2)某校科技小组的同学们采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
19.下列有关化学用语表示和概念判断叙述正确的是( )
| A. | 氢氧根离子的电子式: | |
| B. | 氯原子的结构示意图: | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | SO2、NH3的水溶液能导电,故都属于电解质 |
16.关于胶体和溶液的叙述中正确的是( )
| A. | 胶体与溶液的本质区别是能否发生丁达尔效应 | |
| B. | 胶体加入某些盐可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象,溶液也能发生丁达尔现象 |
13.分枝酸可用于生化研究,其结构简式如图所示.下列关于分枝酸的叙述正确的是( )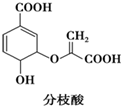

| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1 mol分枝酸分子中含2mol-OH(羟基) | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
17.下列变化过程中,△S<0的是( )
| A. | 氯化钠溶于水中 | B. | CaCO3(S)分解为CaO(S)和CO2(g) | ||
| C. | 干冰的升华 | D. | NH3(g)和HCl(g)反应生成NH4Cl |
18.将10.0mL 10.0%的NaOH溶液和10.0mL 10.0%的盐酸混合后,溶液呈( )
| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |