题目内容
7.在K2Cr2O7溶液中存在下列平衡:2CrO42- (黄色)+2H+?Cr2O72- (橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使CrO42-的物质的量增大,可以在溶液中加入①H+ ②OH- ③K+ ④CO32-.( )| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 在K2Cr2O7溶液中存在下列平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,欲使Cr2O72-(橙红色)的物质的量增大,平衡应该向逆反应方向移动,可以采用减小反应物浓度的方法,据此进行解答.
解答 解:①向溶液中加入氢离子,氢离子浓度增大,平衡向正反应方向移动导致CrO42-的物质的量减小,故①错误;
②向溶液中加入氢氧根离子,氢氧根离子和氢离子反应导致氢离子浓度降低,平衡向逆反应方向移动,则CrO42-的物质的量增大,故②正确;
③向溶液中加入钾离子,钾离子不参加反应,所以对平衡无影响,故③错误;
④向溶液中加入CO32-,导H+浓度降低,平衡向着逆向移动,则CrO42-的物质的量增大,故④正确;
故选B.
点评 本题考查了影响化学平衡移动的因素,为高频考点,题目难度中等,注意根据题意分析平衡的移动方向,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.下列生产、生活中的实例中发生了氧化还原反应的是( )
| A. |  用石斧解剖 | B. |  早期的农业耕作 | C. |  简单机械织布 | D. |  祥云火炬燃烧 |
18.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸在一定的条件下反应制得.

下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 该反应是加成反应 | |
| B. | 1 mol羟基扁桃酸能与3mol NaOH反应 | |
| C. | 乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物 | |
| D. | 苯酚和羟基扁桃酸遇上FeCl3溶液都会显色 |
15.X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M.下列叙述正确的是( )
| A. | M的单质能够用来制造光导纤维 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
2.除去下列杂质(括号内是杂质)所用试剂不正确的是( )
| A. | CO2(HCl):用饱和NaHCO3溶液 | B. | CO2(SO2):用饱和KMnO4溶液 | ||
| C. | Cl2(HCl):用饱和NaCl溶液 | D. | SO2(HCl):用饱和NaOH溶液 |
12.部分物质的熔点数据如下表:
下列说法正确的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A. | 金属晶体的熔点不一定比分子晶体的高 | |
| B. | 表中共价化合物分子的所有原子都形成了8电子结构 | |
| C. | 同族元素的氧化物形成的晶体类型一定相同 | |
| D. | AlF3、AlCl3、BCl3都是离子化合物 |
19.化学与社会、科学、技术、环境等有密切关系.下列说法不正确的是( )
| A. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| B. | 氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 | |
| C. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| D. | 用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
16.近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2;
②上述反应的平衡常数表达式K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是C;
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示
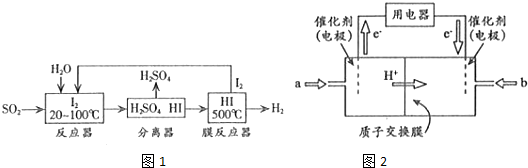
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应的平衡常数表达式K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是C;
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.