题目内容
10.下列有关试验的做法不正确的是( )| A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 分液时,分液漏斗的上层液体应由上口倒出 |
分析 A.应用红色石蕊试纸检验;
B.碳酸氢钠不稳定,易分解;
C.转移液体时应防止液体外溅;
D.分液时应避免液体重新混合而污染.
解答 解:A.氨气可使红色石蕊试纸变蓝色,则应用红色石蕊试纸检验,故A错误;
B.碳酸氢钠不稳定,易分解,可用加热的方法鉴别,故B正确;
C.转移液体时应用玻璃棒引流,以防止液体外溅,故C正确;
D.分液时分液漏斗的上层液体应由上口倒出,以避免液体重新混合而污染,故D正确.
故选A.
点评 本题考查较为综合,涉及物质的检验、分离、溶液的配制等问题,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
19.X、Y、Z均为短周期元素,它们在周期表
中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为31,请回答:
(1)Z的单质与NaOH 溶液反应的化学方程式2Al+2H2O+2NaOH=3H2↑+2NaAlO2
(2)X与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
| X | ||
| Y | Z |
(1)Z的单质与NaOH 溶液反应的化学方程式2Al+2H2O+2NaOH=3H2↑+2NaAlO2
(2)X与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
1.下列说法正确的是( )
| A. | 只有活泼金属与活泼非金属之间才能存在离子键 | |
| B. | 含有金属元素的物质中一定含有离子键 | |
| C. | 化学键是分子中多个原子之间强烈的相互作用 | |
| D. | 具有离子键的化合物是离子化合物 |
18.五颜六色的颜色变化增添了化学的魅力,下列有关反应的颜色叙述正确的是( )
①新制氯水久置后→浅黄绿色消失;②淀粉溶液遇单质碘→蓝色;
③溴化银见光分解→银白色;④Na2CO3溶液中滴加酚酞→红色;
⑤鸡蛋白溶液遇浓硝酸→黄色;⑥碘化银的悬浊液中加入硫化钠晶体,振荡后变黑.
①新制氯水久置后→浅黄绿色消失;②淀粉溶液遇单质碘→蓝色;
③溴化银见光分解→银白色;④Na2CO3溶液中滴加酚酞→红色;
⑤鸡蛋白溶液遇浓硝酸→黄色;⑥碘化银的悬浊液中加入硫化钠晶体,振荡后变黑.
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ①②④⑤⑥ | D. | ①③④⑤⑥ |
15.下列物质露置在空气中,质量会减轻的是( )
| A. | NaOH | B. | Na2CO3•10H2O | C. | 无水CaCl2 | D. | Na 2O2 |
19.要除去碳酸钠固体中的碳酸氢钠,最好的方法是( )
| A. | 加热 | B. | 加入氢氧化钠 | C. | 加入氯化钙 | D. | 通入CO2 |
20.在容积为672mL的烧瓶里充满NO、NO2(气体所处环境均在标准状况下)的混合气体,将其倒立在水槽里,去塞后再通入280mL氧气,恰好完全反应,且水充满烧瓶(气体体积都已折合为标准状况),下列有关叙述中正确的是( )
| A. | 总反应为NO+NO2+O2+H2O═2HNO3 | |
| B. | 总反应为2NO+10NO2+4O2+6H2O═12HNO3 | |
| C. | 生成硝酸的物质的量浓度接近0.03 mol/L | |
| D. | 生成硝酸的物质的量浓度约为0.045 mol/L |
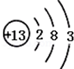 根据如图的原子结构示意图回答下列问题.
根据如图的原子结构示意图回答下列问题.