题目内容
2.近年来特大地震灾害频繁发生,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.工业上制漂白粉有以下工序:(1)海水晒盐.
(2)粗盐提纯:粗盐中主要含有MgCl2、Na2SO4和CaCl2杂质,设计如下方案:
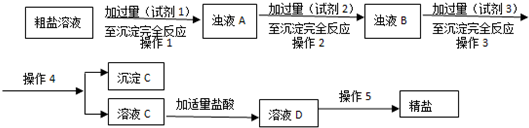
①试剂1~试剂3依次为:BaCl2、Na2CO3、NaOH(填Na2CO3、NaOH或者BaCl2)
②沉淀C含有BaSO4、Mg(OH)2还有CaCO3、BaCO3(用化学式表示).
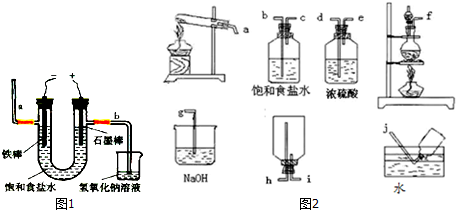
(3)电解法制氯气:观察如图1,回答:
①电解反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑.
②若饱和食盐水中含有酚酞,通电后铁棒(填铁棒或石墨棒)附近变红.图2中b端产生的气体如何检验用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气
(4)制取漂白粉:
a.将氯气通入石灰乳[Ca(OH)2]中反应,化学方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
b.在①漂白粉 ②MgCl2③盐酸 ④氯气 ⑤铁 ⑥Na2O⑦稀硫酸 ⑧CO2 ⑨液氨 ⑩酒精 中属于电解质的是②⑥(填序号,下同),属于非电解质的是⑧⑨⑩.
(5)实验室加热MnO2和浓盐酸混合物来制取氯气.
①在如图2下列各装置中,选用必要的装置,制备纯净干燥的Cl2,并按从左到右的顺序连接仪器,用接口字母按顺序连接为:fbcdeihg.(下列装置不一定全部都使用)
②若将制得的Cl2通入碘化钠溶液中,现象是溶液由无色变为棕黄色,再往其中滴加四氯化碳振荡、静置,现象是溶液分层,上层为接近无色,下层为紫红色.
分析 (2)粗盐中主要含有MgCl2、Na2SO4和CaCl2杂质,根据题中提供的试剂,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,据此答题;
(3)电解法制氯气,是电解食盐水生成氢氧化钠、氢气、氯气,在电解池的阳极产生氯气,阴极产生氢气,同时有氢氧化钠产生,据此答题;
(4)工业上制漂白粉是用氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,据此将物质分类;
(5)①实验室加热MnO2和浓盐酸加热制氯气,由于氯化氢易挥发,所以制得的氯气中含有氯化氢和水份,所以制得的氯气通过饱和食盐水除氯化氢,再通过浓硫酸干燥得纯净氯气,制得的氯气可排空气法收集,尾气用氢氧化钠溶液吸收;
混合物来制取氯气.
②氯气能置换出碘化钾中的碘,碘易溶于四氯化碳,四氯化碳的密度大于水,据此判断反应现象.
解答 解:(2)粗盐中主要含有MgCl2、Na2SO4和CaCl2杂质,根据题中提供的试剂,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,
①根据上面的分析可知,试剂1~试剂3依次为:BaCl2、Na2CO3、NaOH(答案不唯一,只要Na2CO3在BaCl2之后),
故答案为:BaCl2、Na2CO3、NaOH(只要Na2CO3在BaCl2之后);
②沉淀C含有BaSO4、Mg(OH)2还有CaCO3、BaCO3,
故答案为:CaCO3、BaCO3;
(3)电解法制氯气,是电解食盐水生成氢氧化钠、氢气、氯气,在电解池的阳极产生氯气,阴极产生氢气,同时有氢氧化钠产生,
①电解反应的化学方程式为 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
②电解食盐水时,铁做阴极,石墨棒做阳极,氢氧化钠在阴极即铁棒附近产生,所以通电后 铁棒附近变红,图中b端产生氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气,
故答案为:铁棒;用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气;
(4)工业上制漂白粉是用氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,所以在上述物质中属于电解质的是②⑥,属于非电解质的是⑧⑨⑩,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;②⑥;⑧⑨⑩;
(5)①实验室加热MnO2和浓盐酸加热制氯气,由于氯化氢易挥发,所以制得的氯气中含有氯化氢和水份,所以制得的氯气通过饱和食盐水除氯化氢,再通过浓硫酸干燥得纯净氯气,制得的氯气可排空气法收集,尾气用氢氧化钠溶液吸收,所以实验装置按从左到右的顺序连接仪器,用接口字母按顺序连接为:f b c d e i h g,
故答案为:f b c d e i h g;
②氯气能置换出碘化钾中的碘,Cl2通入碘化钠溶液中,现象是溶液由无色变为棕黄色,碘易溶于四氯化碳,四氯化碳的密度大于水,所以滴加四氯化碳振荡、静置,现象是溶液分层,上层为接近无色,下层为紫红色,
故答案为:溶液由无色变为棕黄色;溶液分层,上层为接近无色,下层为紫红色.
点评 本题考查了粗盐的提纯、氯气制备、除杂、漂白粉的制备等内容,注意除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,题目难度中等,注意元素化合物知识在实验分析中的灵活运用.

| A. | 环烷烃 | B. | 芳香烃 | ||
| C. | 含有5个碳原子的烃 | D. | 二烯烃 |
| 一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205 |
| 对应的二甲苯 | -13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |

(2)完全燃烧下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14),等物质的量的上述四种烃,耗氧量最小的为③(填写序号);等质量时,则耗氧量最大的为①(填写序号).
(3)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为
 .
.②若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯.
(4)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链.它完全燃烧时所消耗O2的体积是同状况下该烃蒸气体积的8.5倍,由此分析回答:
①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,则该烃的结构简式为CH2═CH-CH2-CH2-CH═CH2
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为
 (填任一种).
(填任一种). | A. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| B. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 分液时,分液漏斗的上层液体应由上口倒出 |
| A. | 目前加碘食盐中主要添加的是KIO3 | |
| B. | 注射用的生理盐水的浓度为0.09% | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | 在空气质量日报中CO2含量属于空气污染指数 |
| A. | 标准状况下,11.2 L的戊烷所含的分子数为0.5NA | |
| B. | 30 g乙烷所含共用电子对数目为6NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有C2H4、C3H6、C4H8的混合气体共14 g,其原子数为3NA |
| A. | v(A)=0.01mol•L-1s-1 | B. | v(B)=0.02mol•L-1s-1 | ||
| C. | v(C)=1.50mol•L-1min-1 | D. | v(D)=0.50mol•L-1min-1 |
| A. | 离子键就是阴、阳离子间的静电引力 | |
| B. | 所有金属元素与所有非金属元素间都能形成离子键 | |
| C. | 钠原子与氯原子结合形成离子键 | |
| D. | 在离子化合物CaCl2中,两个氯离子间也存在离子键 |
 某期刊封面上的一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上的一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )