题目内容
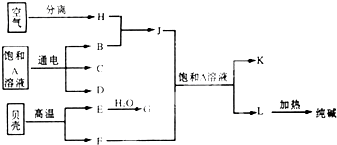 以海水中常见的物质A为原料可以发展很多种工业,如图中包含了几种基本工业生产,请根据各物质之间的转化关系.回答下列问题:
以海水中常见的物质A为原料可以发展很多种工业,如图中包含了几种基本工业生产,请根据各物质之间的转化关系.回答下列问题:(1)C和D、C和G反应都可以制取消毒剂.C和G反应制取的消毒剂中有效成分的化学式为
(2)将F和J通入A的饱和溶液中的顺序为
A.先通入F后通入J
B.先通入J后通入F
C.同时通入
D.没有先后顺序要求
(3)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品mg
| 水 |
| 溶解 |
| 过量BaCl2溶液 |
| 过滤 |
| 水 |
| 洗涤 |
| 低温烘干、冷却、称重 |
①检验沉淀是否洗涤干净所用到的试剂是
②样品中NaCl的质量分数的数学表达式为
考点:海水资源及其综合利用
专题:实验设计题
分析:电解A溶液生成三种物质,且A是海水中常见物质,则A为NaCl,贝壳的成分是CaCO3,高温下煅烧生成CaO和CO2,E和水反应生成G,加热L得到纯碱,则L为NaHCO3,二氧化碳、氨气通入氯化钠溶液中得到碳酸氢钠固体和氯化铵,则K为NH4Cl,J为NH3、F为CO2,所以E为CaO、G为Ca(OH)2,氢气和氮气生成氨气,将空气分离得到氧气、氮气,所以H为N2、B为H2,C和D、C和G反应都可以制取消毒剂,则C是Cl2,D为NaOH,氯化钡和碳酸钠反应生成碳酸钡沉淀,根据碳酸钡计算碳酸钠质量,从而确定碳酸钠质量分数,剩余部分为氯化钠,再结合题目解答.
解答:
解:电解A溶液生成三种物质,且A是海水中常见物质,则A为NaCl,贝壳的成分是CaCO3,高温下煅烧生成CaO和CO2,E和水反应生成G,加热L得到纯碱,则L为NaHCO3,二氧化碳、氨气通入氯化钠溶液中得到碳酸氢钠固体和氯化铵,则K为NH4Cl,J为NH3、F为CO2,所以E为CaO、G为Ca(OH)2,氢气和氮气生成氨气,将空气分离得到氧气、氮气,所以H为N2、B为H2,C和D、C和G反应都可以制取消毒剂,则C是Cl2,D为NaOH,
(1)通过以上分析知,C是氯气、G是氢氧化钙,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂粉精的有效成分是Ca(ClO)2,故答案为:Ca(ClO)2;
(2)因为二氧化碳不易溶于氯化钠溶液,但氨气极易溶于水中,所以先通入氨气后通入二氧化碳,故选B;
(3)①碳酸钡晶体上吸附有氯离子,所以要进行洗涤,向洗涤液中滴加硝酸银溶液,如果不产生白色沉淀就说明洗涤干净,否则洗涤不干净,故答案为:AgNO3溶液;
②氯化钡和碳酸钠反应生成碳酸钡沉淀,所以得到的沉淀是碳酸钡,根据碳原子守恒得n(BaCO3)=n(Na2CO3)=
=
mol,则m(Na2CO3)=
mol×106g/mol=
g,氯化钠质量分数=(1-
)×100%=
×100%;
故答案为:(
)×100%;
(1)通过以上分析知,C是氯气、G是氢氧化钙,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂粉精的有效成分是Ca(ClO)2,故答案为:Ca(ClO)2;
(2)因为二氧化碳不易溶于氯化钠溶液,但氨气极易溶于水中,所以先通入氨气后通入二氧化碳,故选B;
(3)①碳酸钡晶体上吸附有氯离子,所以要进行洗涤,向洗涤液中滴加硝酸银溶液,如果不产生白色沉淀就说明洗涤干净,否则洗涤不干净,故答案为:AgNO3溶液;
②氯化钡和碳酸钠反应生成碳酸钡沉淀,所以得到的沉淀是碳酸钡,根据碳原子守恒得n(BaCO3)=n(Na2CO3)=
| ng |
| 197g/mol |
| n |
| 197 |
| n |
| 197 |
| 106n |
| 197 |
| ||
| m |
m-
| ||
| m |
故答案为:(
m-
| ||
| m |
点评:本题考查了物质转化关系的应用,物质性质的综合应用,特征反应的判断利用,电解原理的分析利用,化学平衡的影响因素运用判断,物质的除杂方法和杂质的含量测定方法和有关计算.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
有机化学中取代反应范畴很广,下列3个反应中,属于取代反应范畴的是(填写相应的字母) ( )
A、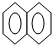 +HNO3 +HNO3
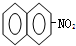 +H2O +H2O | |||
B、
| |||
C、2CH3CH2OH
|
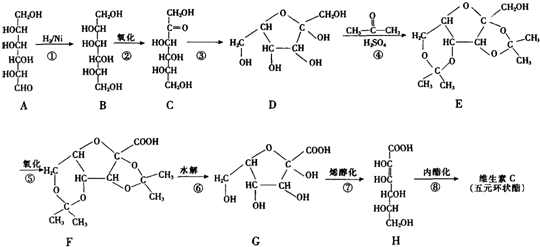






 消去HCl后的产物记为F,写出两种F的能发生银镜反应、且只含3种不同化学环境氢原子的同分异构体的结构简式.
消去HCl后的产物记为F,写出两种F的能发生银镜反应、且只含3种不同化学环境氢原子的同分异构体的结构简式.