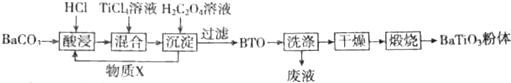
题目内容
1.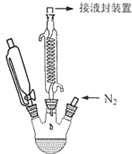 二茂铁的化学式为(C5H5)2Fe,它是一种橙黄色针状晶体,熔点173--174℃,100℃以上显著升华,沸点249℃,不溶于水,可溶于甲醇、乙醇、乙醚和苯等有机溶剂,可作高性能的火箭燃料添加剂.实验室制备二茂铁的反应原理为:8KOH+2C5H6+FeCl2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$(C5H5)2Fe+2KCl+6KOH•H2O实验装置如图所示(加热及磁力搅拌装置未画出).
二茂铁的化学式为(C5H5)2Fe,它是一种橙黄色针状晶体,熔点173--174℃,100℃以上显著升华,沸点249℃,不溶于水,可溶于甲醇、乙醇、乙醚和苯等有机溶剂,可作高性能的火箭燃料添加剂.实验室制备二茂铁的反应原理为:8KOH+2C5H6+FeCl2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$(C5H5)2Fe+2KCl+6KOH•H2O实验装置如图所示(加热及磁力搅拌装置未画出).(1)通入氮气的目的是排尽装置中空气,防止实验过程中亚铁离子被氧化KOH固体所起的作用是使环戊二烯(C5H6)脱去质子,另一个作用是吸收反应生成水
(2)下列有关反应开始和结束的实验操作合理的是bc(填编号).
a.先加热,再通冷凝水 b.先通冷凝水,再加热
c.先停止加热,再停止通冷凝水 d.先停止通冷凝水,再停止加热
(3)反应后可用乙醚萃取、蒸馏分离得到二茂铁粗产品,若欲进一步提纯,最简单的方法是升华;若本次实验取用环戊二烯(密度为0.877g•cm-3) 6.6mL其它物质足量,所得产品质量为5.0g,则产率为61.3%(保留3位有效数字).
分析 (1)二茂铁中铁是+2价,易被空气中氧气氧化;由方程式可知,KOH吸收反应生成水;
(2)应用冷凝水充分冷却,防止有机物挥发或产品升华;
(3)二茂铁易升华,利用升华进行提纯;根据戊二烯计算二茂铁的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气,防止实验过程中亚铁离子被氧化,由方程式可知,KOH吸收反应生成水,
故答案为:排尽装置中空气,防止实验过程中亚铁离子被氧化;吸收反应生成水;
(2)开始时,应先投入冷凝水防止有机物挥发,导致损失;反应结束后,先停止加热,再停止通冷凝水,防止有机物挥发或产品升华,
故答案为:bc;
(3)二茂铁易升华,利用升华进行提纯,二茂铁的理论产量为$\frac{0.877g/mL×6.6mL}{66g/mol}$×$\frac{1}{2}$×186g/mol=8.1561g,则产率=$\frac{5.0g}{8.1561g}$×100%=61.3%,
故答案为:升华;61.3%.
点评 本题考查物质合成实验,涉及对操作与药品的分析评价、物质的分离提纯、产率计算等,题目素材中学比较陌生,注意对题目信息的一样,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.NA为阿伏伽德罗常数的值.下列说法错误的是( )
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下CH3COONH4溶液pH=7,1L 0.1mol•L-1该溶液中NH4+离子数为0.1NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量NaOH溶液中水解得到乙醇分子数为NA |
9.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率-v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A. | $\overline{v}$(NH3)=0.01 mol/(L•s) | B. | $\overline{v}$(O2)=0.00l0 mol/(L•s) | ||
| C. | $\overline{v}$(NO)=0.00l0 mol/(L•s) | D. | $\overline{v}$(H2O)=0.045 mol/(L•s) |
16.NA 代表阿伏加德罗常数的值.下列说法正确的是( )
| A. | C2H4 和C3H6的混合物的质量为a g,所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 标准状况下,2.24 L 2H35Cl 中所含中子数为1.8NA | |
| C. | 50 mL 12 mol•L-1 盐酸与足量MnO2 共热,转移的电子数为0.3NA | |
| D. | 1 L O.lmol•L-1的NaHCO3 溶液中HCO3-和CO32-的离子数之和为0.1NA |
6.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D、C和E分别同主族.A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说确的是( )
| A. | 原子半径D>E>C>B | |
| B. | A、C、D、E四种元素形成的化合物溶于水一定显酸性 | |
| C. | C、D形成的化合物是离子化合物,只含有离子键 | |
| D. | A、C形成的化合物只有氧化性没有还原性 |
15.如图所示的某有机反应,其反应类型为( )
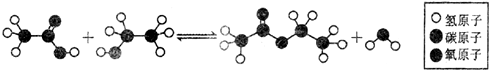

| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 加聚反应 |