题目内容
11.用石墨作电极,电解质溶液中各离子浓度之比如下:C(Cu2+):C(Na+):C(Cl-)=1:2:4,在任何情况下,阴、阳两极不可能同时发生的反应是( )| A. | 阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑ | |
| B. | 阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑ | |
| C. | 阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ | |
| D. | 阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ |
分析 放电时,阳离子放电先后顺序为Cu2+>H+>Na+,阴离子放电先后顺序为Cl->OH-,溶液中C(Cu2+):C(Na+):C(Cl-)=1:2:4,当阴极上Cu2+完全放电而析出,阳极上有一半的Cl-放电,继续电解,阴极上H+放电、阳极上Cl-放电,当Cl-完全放电时,继续电解,阴极上H+放电、阳极上OH-放电,据此分析解答.
解答 解:放电时,阳离子放电先后顺序为Cu2+>H+>Na+,阴离子放电先后顺序为Cl->OH-,溶液中C(Cu2+):C(Na+):C(Cl-)=1:2:4,当阴极上Cu2+完全放电而析出,阳极上有一半的Cl-放电,继续电解,阴极上H+放电、阳极上Cl-放电,当Cl-完全放电时,继续电解,阴极上H+放电、阳极上OH-放电,
A.第三阶段时,阴极上H+放电、阳极上OH-放电,相当于电解水,所以阴极:2H++2e-=H2↑、阳极:4OH--4e-=2H2O+O2↑,故A不选;
B.当阴极上Cu2+放电时,阳极上Cl-放电,所以阴极:Cu2++2e-=Cu、阳极:2Cl--2e-=Cl2↑,故B选;
C.第二阶段电解时,相当于电解稀盐酸,阴极上H+放电、阳极上Cl-放电,所以阴极:2H++2e-=H2↑、阳极:2Cl--2e-=Cl2↑,故C不选;
D.当阴极上Cu2+放电时,阳极上Cl-放电,所以阴极:Cu2++2e-=Cu、阳极:2Cl--2e-=Cl2↑,故D不选;
故选B.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,正确分析各个阶段发生的电极反应,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
6.有以下六种溶液:①Ba(OH)2溶液;②Ba(NO3)2溶液;③KMnO4溶液;④品红试液;⑤Na2SiO3溶液;⑥NaHCO3溶液,可用于区分CO2和SO2这两种气体的有( )种.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.化学不仅在书本里,还在生活中.比如厨房里常用小苏打或苏打粉去除鱼腥味,而残留的小苏打或苏打粉异味则应用下列哪种物品去除( )
| A. | 陈醋 | B. | 食盐 | C. | 味精 | D. | 花生油 |

 .
.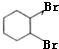 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,反应类型消去反应;
+2NaBr+2H2O,反应类型消去反应;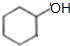 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型消去反应;
+H2O,反应类型消去反应;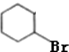 +H2O,反应类型取代反应;
+H2O,反应类型取代反应; +2H2O.
+2H2O.