题目内容
11.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步骤1:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL.
步骤2:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤:1相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL.
则BaCl2溶液浓度为$\frac{({V}_{0}b-{V}_{1}b)}{y}$ mol•L-1.若步骤2中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将偏大(填“偏大”或“偏小”).
分析 利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行,根据2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为总盐酸的物质的量减去过量的盐酸,分析BaCl2溶液的浓度计算公式,若步骤2中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大.
解答 解:步骤2:待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42-+2H+═Cr2O72-+H20 的盐酸的物质的量为:V1×10-3×bmol,
步骤1:用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×10-3×bmol,Ba2++CrO42-═BaCrO4↓,与Ba2+反应的CrO42-的物质的量为V0×10-3×bmol-V1×10-3×bmol=(V0-V1)b×10-3mol,
步骤2:移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度为:$\frac{({V}_{0}-{V}_{1})b×1{0}^{-3}}{y×1{0}^{-3}}$mol/L=$\frac{({V}_{0}b-{V}_{1}b)}{y}$mol/L,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,V1减小,则Ba2+浓度测量值将偏大,
故答案为:$\frac{({V}_{0}b-{V}_{1}b)}{y}$;偏大.
点评 本题考查了间接酸碱滴定法计算,侧重考查各沉淀离子间量的关系,注意与Ba2+反应的CrO42-的物质的量为总盐酸的物质的量减去过量的盐酸是解答的关键,题目难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
1.下列烃分子的二氯代物有三种的是( )
| A. | CH3-CH2-CH3 | B. |  | C. |  | D. |  |
2.下列关于有机物的说法正确的是( )
| A. | 乙酸的分子式为CH3COOH,属于弱电解质 | |
| B. | 苯分子中没有碳碳双键,因此苯不能发生加成反应 | |
| C. | 交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 | |
| D. | 乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同 |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L 0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA |
16.含一个苯环(不再含有其他环状结构)的化合物的分子式为 C11H16,分子中还有 2 个-CH3,2 个-CH2-和一个-CH-,则该分子符合上述条件的可能结构有( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
3.下列单体在一定条件下能发生加聚反应生成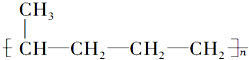 的是( )
的是( )
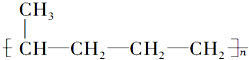 的是( )
的是( )| A. | CH3CH═CH2和CH4 | B. | 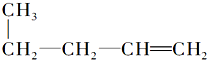 | ||
| C. | CH3CH═CH2和CH4═CH2 | D. | 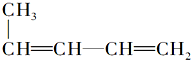 |
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,22.4L O2所含的原子数为2NA | |
| B. | 标准状况下,22.4L H2所含的分子数为NA | |
| C. | 标准状况下,22.4L H2O所含的分子数为NA | |
| D. | 56g铁粉与盐酸完全反应时转移电子数为3NA |
11.38.4g铜与过量稀硝酸充分反应,发生还原反应的HNO3的物质的量为( )
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
